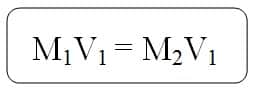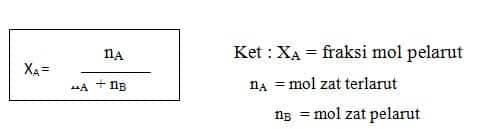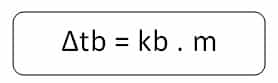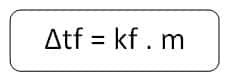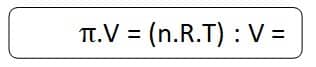
Pengertian Larutan
Larutan adalah campuran yang bersifat homogen antara molekul, atom ataupun iondari dua zat atau lebih. Disebut campuran karena susunannya atau komposisinya dapat berubah. Disebut homogen karena susunanya begitu seragam sehingga tidak dapat diamati adanya bagian-bagian yang berlainan, bahkan dengan mikroskop optis sekalipun. Fase larutan dapat berwujud gas, padat ataupun cair. Larutan gas misalnya udara. Larutan padat misalnya perunggu, amalgam dan paduan logam yang lain. Larutan cair misalnya air laut, larutan gula dalam air, dan lain-lain. Komponen larutan terdiri dari pelarut (solvent) dan zat terlarut (solute). Pelarut merupakan komponen yang utama yang terdapat dalam jumlah yang banyak, sedangkan komponen minornya merupakan zat terlarut. Larutan terbentuk melalui pencampuran dua atau lebih zat murni yang molekulnya berinteraksi langsung dalam keadaan tercampur. Semua gas bersifat dapat bercampur dengan sesamanya, karena itu campuran gas adalah larutan.
Larutan merupakan suatu campuran yang terdiri dari dua atau lebih zat (dalam kimia). Zat yang jumlahnya lebih sedikit yang ada didalam larutan itu (zat) solut atau terlarut, sedangkan zat yang memiliki jmlah zat lebih banyak dibandingkan dengan zat-zat lain dalam larutan juga disebut solven atau pelarut.
Takaran atau komposisi zat terlarut serta pelarut dalam sebuh larutan dinyatakan dalam konsentrasi larutan, dan sedangkan proses campuran zat terlarut dan pelarut disebut pelarutan (solvasi). Sebagai contoh larutan yang biasa dijumpai ialah padatan yang dilarutkan didalam sebuah cairan, contohnya gula atau garam yang dilarutkan kedalam air. Gas juga bisa dilarutkan dalam sebuah cairan, misalkan karbon dioksida atau oksigen dalam air. selain itu juga, cairan juga dapat larut dalam cairan lain, sementara gas larut dalam gas lain. Terdapat pula larutan padat, misalnya aloi (campuran logam) serta mineral yang tertentu.
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Larutan Garam
Sifat-sifat Larutan
Sifat fisik larutan pada umumnya terbagi menjadi 3 Yaitu:
- Sifat koligatif. tergantung pada jumlah partikel dalam larutan
- Sifat aditif. tergantung pada atom total dalam molekul atau pada jumlah sifat konstituen dalam larutan,
- Sifat konstitutif, tergantung pada atom penyusun molekuk (pada jenis atom dan jumlah atom)
Sedangkan larutan nyata, tidak mengikuti hukum Roult,, atau terjadi penyimpangan, Penyimpangannya dapat positif dan negatif,, Penyimpangan negatif jika Penyimpangan cukup besar, kurva tekanan uap total memperlihatkan minimum, mengikuti hukum Roult, kecenderunagn melepaskan diri, Sedangkan untuk penyimpangan positif jikakurva tekanan uap total maksimum, tekanan parsial lebih besar daripada hukum Roult, kecenderungan melepaskan diri akibat ketidaksamaan kepolaran atau tekanan dalam dari konstituen
Larutan ideal
Jika interaksi antarmolekul komponen larutan sama besar terhadap interaksi antarmolekul komponen tersebut pada keadaan murni, maka terbentuklah idealisasi yang disebut larutan ideal. Larutan ideal mematuhi hukum Raoult, yaitu tekanan uap pelarut (cair) berbanding tepat lurus terhadap fraksi mol pelarut dalam larutan.
Larutan yang benar-benar ideal tidak ada dialam, tetapi larutan memenuhi hukum Raoult sapai batas tertentu. Contoh larutan yang pas dianggap ideal ialah campuran benzana serta toluena. Cairan lain larutan ideal merupakan volumenya ialah jumlahan tepat volume komonen-komponen penyusunnya. Pada larutan non-ideal, penjumlahan volue zar terlarut murni serta pelarut murni tidaklah sama terhadap volume larutan.
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Larutan Basa
Komponen dan Pembuatan Larutan
Komponen Larutan
Suatu larutan terdiri atas dari dua komponen yang penting. Biasanya salah satu komponen yang mengandung jumlah zat yang lebih banyak disebut pelarut (solvent). Pelarut dipandang sebagai pembawa atau medium zat terlarut yang dapat berperan serta dalam reaksi kimia. Kemudian, komponen lainnya yang mengandung zat yang lebih sedikit disebut zat terlarut (solute). Kedua komponen dalam larutan dapat sebagai pelarut atau terlarut tergantung komposisinya. Larutan di bagi menjadi tiga jenis yitu:
- Larutan tak jenuh yaitu larutan yang mengandung solute kurang dari yang diperlukan untuk membuat larutan jenuh.
- larutan jenuh yaitu suatu larutan yang mengandung sejumlah solute yang larut dan mengadakan kesetimbangan dengan solute padatnya.
- Larutan lewat jenuh yaitu larutan yang mengandung lebih banyak solute yang diperlukan dari pada solvent.
Berdasarkan banyak sedikitnya zat terlarut dibedakan menjadi dua yaitu:
- Larutan pekat merupakan larutan yang mengandung relatif lebih banyak solute.
- Larutan encer merupakan larutan yang relatif sedikit mengandung solute.
Pembuatan Larutan
Proses pengenceran adalah mencampur larutan pekat (konsentrasi tinggi) dengan cara menambahkan pelarut agar diperoleh volume akhir yang lebih besar. Jika suatu larutan senyawa kimia yang pekat diencerkan, kadang-kadang sejumlah panas dilepaskan. Hal ini terutama dapat terjadi pada pengenceran asam sulfat pekat. Agar panas ini dapat dihilangkan dengan aman, asam sulfat pekat yang harus ditambahkan ke dalam air, tidak boleh sebaliknya. Jika air ditambahkan ke dalam asam sulfat pekat, panas yang dilepaskan sedemikian besar yang dapat menyebabkan air mendadak mendidih dan menyebabkan asam sulfat memercik. Jika kita berada di dekatnya, percikan asam sulfat ini merusak kulit.
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Larutan Buffer / Penyangga
Konsentrasi Larutan
Untuk menyatakan komposisi larutan secara kuantitatif digunakan konsentrasi. Konsentrasi adalah perbandingan jumlah zat terlarut dan jumlah pelarut, dinyatakan dalam satuan volume (berat, mol) zat terlarut dalam sejumlah volume tertentu dari pelarut. Berdasarkan hal ini muncul satuan-satuan konsentrasi, yaitu fraksi mol, molaritas, molalitas, normalitas, ppm serta ditambah dengan persen massa dan persen volume.
Banyak cara menentukan konsentrasi larutan yang semuanya menyatakan kuantitas zat terlarut dalam kuantitas pelarut atau larutan. Dengan demikian, setiap sistem konsentrasi harus menyatakan hal-hal sebgai berikut :
- Satuan yang digunakan untuk zat terlarut
- Kuantitas kedua dapat berupa pelarut atau larutan keseluruhan
- Satuan yang digunakan untuk kuantitas kedua konsentrasi.
Untuk membuat larutan dengan konsentrasi tertentu harus diperhatikan:
- Apabila dari padatan, pahami terlebih dahulu satuan yang diinginkan. Berapa volum atau massa larutan yang akan dibuat.
- Apabila larutan yang lebih pekat, satuan konsentrasi larutan yang diketahui dengan satuan yang diinginkan harus disesuaikan. Jumlah zat terlarut sebelum dan sesudah pengenceran adalah sama, dan memenuhi persamaan :
- M1 : Konsentrasi larutan sebelum diencerkan
- V1 : Volume larutan atau massa sebelum diencerkan
- M2 : Konsentrasi larutan setelah diencerkan
- V2 : Volume larutan atau massa setelah diencerkan
Konsentrasi dapat dinyatakan dengan beberapa cara, yaitu:
1. Molaritas
Molaritas ialah jumlah mol zat terlarut dalam 1 liter larutan. Dimensi molaritas ialah mol/L atau mol L-1 , disingkat M dan diucapkan molar. Larutan yang mengandung 1 mol zat terlarut dalam 1 liter larutan disebut 1 molar dan ditulis 1 M.
Molaritas ialah cara yang paling lazim untuk menyatakan komposisi larutan encer. Untuk pengukur yang cermat cara ini kurang menguntungkan karena sedikit ketergantungan pada suhu. Jika larutan dipanaskan atau didinginkan, volume berubah sedangkam mol akan tetap sehingga molaritas akan berubah.
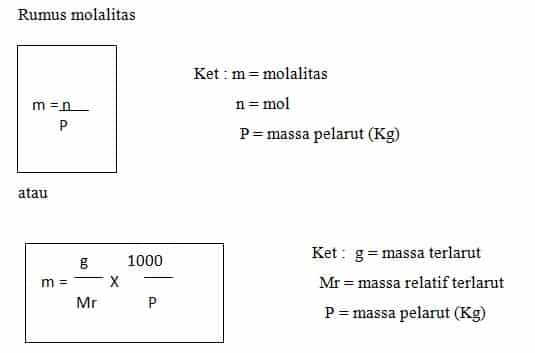
2. Molalitas
Molalitas ialah jumlah zat terlarut pada tiap kilogram pelarut, dalam molalitas tidak ada volume, namun massa yang tidak berepengaruh pada suhu.
3. Persen Massa
Persen massa atau sering disebut persen bobot per bobot (% b/b), menyatakan jumlah massa zat terlarut dalam 100 bagian massa larutan Rumus persen massa :
4. Persen Volume
Persen volume atau persen volum per volum (% V/V) menyatakan jumlah zat terlarut dalam 100 bagian volume larutan. Rumus persen volume
5. PPM (part per million)
ppm (part per million) menyatakan jumlah bagian komponen dalam sejuta bagian campuran.
6. Fraksi mol
Fraksi mol menyatakan perbandingan mol zat terlarut dengan jumlah mol seluruh larutan (mol terlarut + mol pelarut). Rumus Fraksi mol :
larutan terhadap jumlah seluruh zat dalam larutan.
7. Normalitas
Normalitas menyatakan jumlah garam ekuivelen zat terlarut dalam 1 liter larutan. Satuannya dilambangkan dengan N dan disebut Normal.
Valensi menyatakan banyaknya ion H+ atau OH– (dalam larutan asam dan basa) yang dilepaskan.
Baca Juga Artikel Yang Mungkin Berhubungan : Larutan Asam – Pengertian, Ciri, Sifat, Hujan, Contohnya
Jenis-jenis Larutan
1. Berdasarkan kemampuannya menghantarkan listrik
Berdasarkan kemampuannya menghantarkan listrik, larutan dapat dibedakan sebagai larutan elektrolit dan larutan non-elektrolit. Larutan elektrolit mengandung zat elektrolit sehingga dapat menghantarkan listrik, sementara larutan non-elektrolit tidak dapat menghantarkan listrik.
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik Zat elektrolit dapat berupa senyawa ion atau senyawa kovalen polar yang dapat terhidrolisis (bereaksi dengan air). Larutan elektrolit terbentuk dari suatu zat yang larut atau terurai kedalam bentuk ion-ion dan membuat larutan menjadi konduktor elektrik. Ion merupakan atom-atom yang bermuatan elektrik. Contoh : larutan HCl.
Arus listrik adalah aliran muatan. Arus listrik melalui logam adalah aliran elektron, dan arus listrik melalui larutan adalah aliran ion-ion. Ion-ion ini berasal dari zat-zat yang terlarut dan terionisasi menjadi atom-atom bermuatan. Karena itu, larutan elektrolit dapat berupa asam, basa maupun garam.
- Larutan asam adalah larutan dimana zat terlarutnya terdisosiasi melepaskan ion hidrogen (H+) di dalam larutan.
- Larutan basa adalah larutan dimana zat terlarutnya terdisosiasi melepaskan ion hidroksida (OH–) di dalam larutan.
- Larutan garam adalah larutan dimana zat terlarutnya bersifat netral dan terdisosiasi menjadi ion-ion pembentuk garamnya di dalam larutan.
Jenis dan konsentrasi (kepekatan) suatu larutan dapat berpengaruh terhadap daya hantar listriknya. Untuk menunjukkan kekuatan elektrolit digunakan derajat ionisasi yaitu jumlah ion bebas yang dihasilkan oleh suatu larutan. Derajat ionisasi (a) didapat dari perbandingan antara jumlah zat yang mengion dengan jumlah zat yang dilarutkan. Makin besar harga a , makin kuat keelektrolitan larutan tersebut. Dari nilai derajat ionisasi tersebut, larutan elektrolit dapat dibedakan menjadi elektolit kuat dan lemah.
Larutan elektrolit lemah adalah larutan elektrolit dimana zat yang terlarut tidak terionisasi seluruhnya (ionisasi sebagian 0 < a < 1 ). Sifat kekonduktorannya buruk karena sedikitnya zat yang mengion. Persamaan reaksi ionisasi elektrolit lemah ditandai dengan panah dua arah (reaksi reversible) artinya tidak semua molekul terurai (ionisasi tidak sempurna). Larutan ini biasanya berupa larutan asam lemah dan basa lemah,
- Asam Lemah
Asam lemah adalah zat asam yang tidak terionisasi seluruhnya ketika zat asam tersebut dilarutkan dalam air. Tetapan ionisasinya dituliskan dalam bentuk Ka. Ka didefinisikan sebagai: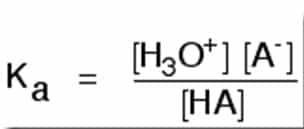
-
Basa Lemah
Basa lemah adalah zat basa yang tidak berubah seluruhnya menjadi ion hidroksida dalam larutan. Tetapan ionisasinya dituliskan dalam bentuk Kb. Kb didefinisikan sebagai: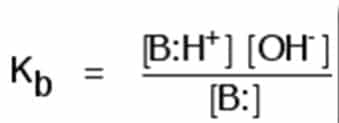
|
Larutan Elektrolit |
Larutan Non Elektrolit |
||
| 1.
2.
3. |
Dapat menghantarkan listrik
Terjadi proses ionisasi Contoh: |
1.
2. 3. |
Tidak dapat menghantarkan listrik Tidak terjadi proses ionisasi Lampu tidak menyala dan tidak ada gelembung gasContoh: Larutan gula (C12H22O11) Larutan urea (CO NH2)2 Larutan alkohol C2H5OH (etanol) Larutan glukosa (C6H12O6) |
2. Berdasarkan fase zat terlarut dan pelarutnya.
Tabel berikut menunjukkan contoh-contoh larutan berdasarkan fase komponen-komponennya.
|
Contoh larutan |
Zat terlarut |
|||
|
Gas |
Cairan |
Padatan |
||
| Pelarut | Gas | Udara (oksigen dan gas-gas lain dalam nitrogen) | Uap air di udara (kelembapan) | Bau suatu zat padat yang timbul dari larutnya molekul padatan tersebut di udara |
| Cairan | Air terkarbonasi (karbon dioksida dalam air) | Etanol dalam air; campuran berbagai hidrokarbon (minyak bumi) | Sukrosa (gula) dalam air; natrium klorida (garam dapur) dalam air; amalgam emas dalam raksa | |
| Padatan | Hidrogen larut dalam logam, misalnya platina | Air dalam arang aktif; uap air dalam kayu | Aloi logam seperti baja dan duralumin | |
Baca Juga Artikel Yang Mungkin Berhubungan : Larutan Elektrolit : Pengertian, Ciri, Dan Jenis Beserta Contohnya Secara Lengkap
Pengertian Kelarutan
Kelarutan atau solubilitas adalah kemampuan suatu zat kimia tertentu, zat terlarut (solute), untuk larut dalam suatu pelarut (solvent). Kelarutan dinyatakan dalam jumlah maksimum zat terlarut yang larut dalam suatu pelarut pada kesetimbangan. Larutan hasil disebut larutan jenuh. Zat-zat tertentu dapat larut dengan perbandingan apapun terhadap suatu pelarut. Contohnya adalah etanol di dalam air. Sifat ini lebih dalam bahasa Inggris lebih tepatnya disebut miscible.
Pelarut umumnya merupakan suatu cairan yang dapat berupa zat murni ataupun campuran. Zat yang terlarut, dapat berupa gas, cairan lain, atau padat. Kelarutan bervariasi dari selalu larut seperti etanol dalam air, hingga sulit terlarut, seperti perak klorida dalam air. Istilah “tak larut” (insoluble) sering diterapkan pada senyawa yang sulit larut, walaupun sebenarnya hanya ada sangat sedikit kasus yang benar-benar tidak ada bahan yang terlarut. Dalam beberapa kondisi, titik kesetimbangan kelarutan dapat dilampaui untuk menghasilkan suatu larutan yang disebut lewat jenuh (supersaturated) yang metastabil.
Baca Juga Artikel Yang Mungkin Berhubungan : Tabel Periodik Unsur Kimia
Faktor Yang Mempengaruhi Kelarutan
Faktor Yang Mempengaruhi Kelarutan tergantung pada sebagai berikut :
-
Sifat solvent
Kelarutan yang besar terjadi bila molekul-molekul solute mempunyai kesamaan dalam struktur dan sifat-sifat kelistrikan dari molekul-molekul solvent. Bila ada kesamaan dari sifat-sifat kelistrikan, misalnya momen dipol yang tinggi, antara solvent-solvent, maka gaya-gaya tarik yang terjadi antara solute solvent adalah kuat. Sebaliknya, bila tidak ada kesamaan, maka gaya-gaya terik solute solvent lemah.
Secara umum, padatan ionik mempunyai kelarutan yang lebih tinggi dalam solvent polar daripada dalam pelarut non-polar. Juga, jika solvent lebih polar, maka kelarutan dari padatan-padatan ionik akan lebih besar.
-
Suhu
Kelarutan gas dalam air biasanya menurun jika suhu larutan dinaikkan. Gelembung-gelembung kecil yang dibentuk bila air dipanaskan adalah kenyataan bahwa udara yang terlarut menjadi kurang larut pada suhu-suhu yang lebih kecil. Hal yang serupa, tidak ada aturan yang umum untuk perubahan suhu terhadap kelrutan cairan-cairan dan padatan-padatan.
-
Tekanan
Kelarutan dari semua gas naik jika tekanan saham dari gas yang terletak di atas larutan dinaikkan. Secara kuantitatif, hal ini dinyatakan dalam hukum Henry, yang menyatakan bahwa pada suhu tetap perbandingan dari tekanan saham dari solute gas dibagi dengan mol fraksi dari gas dalam larutan adalah tetap.
Satuan Kelarutan
Kelarutan (khususnya untuk zat yang sukar larut) dinyatakan dalam mol L. Jadi kelarutan sama dengan kemolaran dari larutan jenuhnya.
S = n/v dimana n adalah jumlah mol dan v = volume (liter)
Baca Juga Artikel Yang Mungkin Berhubungan : Campuran : Pengertian, Ciri, Dan Macam Serta Contohnya Dalam Ilmu Kimia
Sifat Koligatif Larutan Non-elektrolit
Sifat larutan berbeda dengan sifat pelarut murninya. Terdapat empat sifat fisika yang penting yang besarnya bergantung pada banyaknya partikel zat terlarut tetapi tidak bergantung pada jenis zat terlarutnya. Keempat sifat ini dikenal dengan sifat koligatif larutan. Sifat ini besarnya berbanding lurus dengan jumlah partikel zat terlarut. Sifat koligatif tersebut adalah :
- tekanan uap
- titik didih
- titik beku
- tekanan osmosis.
Menurut hukum sifat koligatif, selisih tekanan uap, titik beku, dan titik didih suatu larutan dengan tekanan uap, titik beku, dan titik didih pelarut murninya, berbanding langsung dengan konsentrasi molal zat terlarut. Larutan yang bisa memenuhi hukum sifat koligatif ini disebut larutan ideal. Kebanyakan larutan mendekati ideal hanya jika sangat encer.
-
Tekanan Uap Larutan
Tekanan uap larutan lebih rendah dari tekanan uap pelarut murninya. Pada larutan ideal, menurut hukum Raoult, tiap komponen dalam suatu larutan melakukan tekanan yang sama dengan fraksi mol kali tekanan uap dari pelarut murni
- PA = tekanan uap yang dilakukan oleh komponen A dalam larutan.
- XA = fraksi mol komponen A.
- P0 = tekanan uap zat murni A.
Dalam larutan yang mengandung zat terlarut yang tidak mudah menguap (tak-atsiri atau nonvolatile), tekanan uap hanya disebabkan oleh pelarut, sehingga PA dapat dianggap sebagai tekanan uap pelarut maupun tekanan uap larutan.
-
Titik Didih Larutan
Titik didih larutan bergantung pada kemudahan zat terlarutnya menguap. Jika zat terlarutnya lebih mudah menguap daripada pelarutnya (titik didih zat terlarut lebih rendah), maka titik didih larutan menjadi lebih rendah dari titik didih pelarutnya, atau dikatakan titik didih larutan turun. Contohnya larutan etil alkohol dalam air titik didihnya lebih rendah dari 100˚C tetapi lebih tinggi dari 78,3˚C (titik didih etil alkohol 78,3˚C dan titik didih air 100˚C). Jika zat terlarutnya tidak mudah menguap (tak-atsiri atau nonvolatile) daripada pelarutnya (titik didih zat terlarut lebih tinggi), maka titik didih larutan menjadi lebih tinggi dari titik didih pelarutnya, atau dikatakan titik didih larutan naik. Pada contoh larutan etil alkohol dalam air tersebut, jika dianggap pelarutnya adalah etil alkohol, maka titik didih larutan juga naik. Kenaikan titik didih larutan disebabkan oleh turunnya tekanan uap larutan.
Berdasar hukum sifat koligatif larutan, kenaikan titik didih larutan dari titik didih pelarut murninya berbanding lurus dengan molalitas larutan.
- Δtb = kenaikan titik didih larutan.
- kb = kenaikan titik didih molal pelarut.
- m = konsentrasi larutan dalam molal.
-
Titik Beku Larutan
Penurunan tekanan uap larutan menyebabkan titik beku larutan menjadi lebih rendah dari titik beku pelarut murninya. Hukum sifat koligatif untuk penurunan titik beku larutan berlaku pada larutan dengan zat terlarut atsiri (volatile) maupun tak-atsiri (nonvolatile).
Berdasar hukum tersebut, penurunan titik beku larutan dari titik beku pelarut murninya berbanding lurus dengan molalitas larutan.
- Δtf = penurunan titik beku larutan.
- kf = penurunan titik beku molal pelarut.
- m = konsentrasi larutan dalam molal.
-
Tekanan Osmose Larutan
Peristiwa lewatnya molekul pelarut menembus membran semipermeabel dan masuk ke dalam larutan disebut osmose. Tekanan osmose larutan adalah tekanan yang harus diberikan pada larutan untuk mencegah terjadinya osmose (pada tekanan 1 atm) ke dalam larutan tersebut. Hampir mirip dengan tekanan pada gas ideal, pada larutan ideal, besarnya tekanan osmose berbanding lurus dengan konsentrasi zat terlarut.
- π= tekanan osmose (atm).
- n = jumlah mol zat terlarut (mol).
- R = tetapan gas ideal = 0,08206 L.atm/mol.K
- T = suhu larutan (K).
- V = volume larutan (L).
- M = molaritas (M = mol/L).
Jika tekanan yang diberikan pada larutan lebih besar dari tekanan osmose, maka pelarut murni akan keluar dari larutan melewati membran semipermeabel. Peristiwa ini disebut osmose balik (reverse osmosis), misalnya pada proses pengolahan untuk memperoleh air tawar dari air laut.
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Unsur Kimia dan Asal usulnya Terlengkap
Istilah Kelarutan
|
Istilah Kelarutan |
Jumlah bagian pelarut yang diperlukan untuk melarutkan 1 bagian zat |
|
| Very soluble | Sangat mudah larut |
< 1 |
| Freely soluble | Mudah larut |
1 – 10 |
| Soluble | Larut |
10 – 30 |
| Sparingly soluble | Agak sukar larut |
30 – 100 |
| Slightly soluble | Sukar larut |
100 – 1000 |
| Very slightly soluble | Sangat sukar larut |
1000 – 10.000 |
| Practically insoluble or insoluble | Praktis tidak larut |
> 10.000 |
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Pengendalian Proses Teknik Kimia Beserta Tipe Dan Contohnya
Contoh Larutan dan Kelarutan
Larutan Asam, Basa dan Garam
1. ASAM
Buah-buahan yang masih muda pada umumnya berasa masam. Sebenarnya rasa masam dalam buah-buahan tersebut disebabkan karena zat kimia yang terkandung di dalamnya yang biasa disebut asam. Secara kimia, asam adalah zat yang dalam air dapat menghasilkan ion hidrogen (H+). Asam akan terionisasi menjadi ion hidrogen dan ion sisa asam yang bermuatan negatif.
Contoh Asam Dalam larutan :
- Asam Askorbat terdapat dalam tomat,jeruk dan sayuran (
- Asam Asetat terdapat dalam larutan cuka
- Asam Sitrat terdapat dalam jeruk
- Asam Borat terdapat dalam larutan pencuci mata
- Asam Klorida terdapat dalam asam lambung dan obat tetes mata
- Asam Nitrat terdapat dalam pupuk dan peledak
- Asam Fosfat terdapat dalam deterjen
- Asam Sulfat terdapat dalam baterai mobil
- Asam Laktat terdapat dalam keju
- Asam Benzoat terdapat dalam bahan pengawet makanan
2.BASA
Basa adalah zat yang dalam air dapat menghasilkan ion hidroksida (OH–). Ion hidroksida terbentuk karena senyawa hidroksida dapat mengikat satu elektron pada saat dimasukkan ke dalam air. Basa dapat menetralisir asam (H+) sehingga dihasilkan air (H2O).
Contoh Basa Dalam larutan:
- Aluminium Hidroksida terdapat dalam deodoran dan antasid
- Kalsium Hidroksida terdapat dalam mortar dan plester
- Magnesium Hidroksida terdapat dalam antasid
- Natrium Hidroksida terdapat dalam bahan sabun
3.GARAM
Garam adalah senyawa yang terbentuk dari reaksi asam dan basa. Terdapat beberapa contoh garam, antara lain: NaCl, CaCl2, ZnSO4, NaNO2, dan lain-lain.
Contoh Garam Dalam larutan:
- Natrium Klorida terdapat dalam garam dapur (NaCI)
- Natrium Bikarbonat terdapat dalam baking soda (NaHCO3)
- Kalsium Karbonat terdapat dalam cat tembok dan bahan karet (CaCO3)
- Kalsium Nitrat terdapat dalam pupuk dan bahan peledak (KNO3)
- Kalium Karbonat terdapat dalam sabun dan kaca (K2CO3)
- Natrium Fosfat terdapat dalam deterjen (Na3PO4)
- Amonium Klorida terdapat dalam baterai kering (NH4CI)
Adapun Contoh Lain dalam Larutan adalah sebagai berikut :
- Contoh Kaloid :
-Larutan gula, larutan garam, udara bersih
-Tepung kanji dalam air, mayones, debu di udara
-Campuran air dan pasir, sel darah merah dan plasma putih dalamplasma darah - Contoh Suspensi:
-Air sungai yang keruh
-Campuran air dengan kopi
-Campuran minyak dengan air