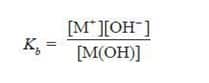Pengertian Larutan Baca, Ciri, Sifat, Macam, Klasifikasi dan Contohnya : adalah suatu zat yang jika dilarutkan dalam air akan menghasilkan ion hidroksida (OH–). Jadi, pembawa sifat basa adalah ion OH– (ion hidroksida)
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Asam, Basa, Dan Garam
Pengertian Larutan Basa
Basa ialah zat(senyawa) yang bisa beraksi dengan asam, menghasilkan senyawa yang disebut garam. Sedangkan basa yaitu suatu zat-zat yang bisa menetralkan asam. Secara kimia, asam dan basa saling berlawanan. Sifat basa pada umumnya ditunjukkan dari rasa pahit dan licin.
Basa adalah suatu zat yang jika dilarutkan dalam air akan menghasilkan ion hidroksida (OH–). Jadi, pembawa sifat basa adalah ion OH– (ion hidroksida), sehingga rumus kimia basa selalu mengandung senyawa OH (X-OH, X adalah atom atau senyawa lain.. misal Na (Natrium) menjadi NaOH = Natrium Hidroksida).
Sedangkan menurut kamus sains bergambar (2000), Basa ialah suatu zat yang bereaksi dengan suatu asam untuk membentuk garam dan air saja, umumnya berupa suatu oksida logam atau hidroksida logam.
Baca Juga Artikel Yang Mungkin Berhubungan : Termokimia : Pengertian, Persaman, Reaksi, Rumus Dan Contoh Soal
Teori Menurut Para Ahli
Teori Menurut Arrhenius
Menurut teori Arrhenius, zat yang dalam air menghasilkan ion H + disebut asam danbasa adalah zat yang dalam air terionisasi menghasilkan ion OH – .
HCl –> H + + Cl –
NaOH –> Na + + OH –
Meskipun teori Arrhenius benar, pengajuan desertasinya mengalami hambatan berat karena profesornya tidak tertarik padanya. Desertasinya dimulai tahun 1880, diajukan pada 1883, meskipun diluluskan teorinya tidak benar. Setelah mendapat bantuan dari Van’ Hoff dan Ostwald pada tahun 1887 diterbitkan karangannya mengenai asam basa. Akhirnya dunia mengakui teori Arrhenius pada tahun 1903 dengan hadiah nobel untuk ilmu pengetahuan.
Sampai sekarang teori Arrhenius masih tetap berguna meskipun hal tersebut merupakan model paling sederhana. Asam dikatakan kuat atau lemah berdasarkan daya hantar listrik molar. Larutan dapat menghantarkan arus listrik kalau mengandung ion, jadi semakin banyak asam yang terionisasi berarti makin kuat asamnya. Asam kuat berupa elektrolit kuat dan asam lemah merupakan elektrolit lemah. Teori Arrhenius memang perlu perbaikan sebab dalam lenyataan pada zaman modern diperlukan penjelasanyang lebih bisa diterima secara logik dan berlaku secara umum. Sifat larutan amoniak diterangkan oleh teori Arrhenius sebagai berikut:
NH 4 OH –> NH 4 + + OH –
Jadi menurut Svante August Arrhenius (1884) asam adalah spesi yang mengandung H + dan basa adalah spesi yang mengandung OH -, dengan asumsi bahwa pelarut tidak berpengaruh terhadap sifat asam dan basa.
Sehingga dapat disimpulkan bahwa:
Asam ialah senyawa yang dalam larutannya dapat menghasilkan ion H + . Basa ialah senyawa yang dalam larutannya dapat menghasilkan ion OH – .
Contoh:
1) HCl (aq) –> H + (aq) + Cl – (aq)
2) NaOH (aq) –> Na + (aq) + OH – (aq)
Baca Juga Artikel Yang Mungkin Berhubungan : Perbedaan Antara Senyawa Ionik Dan Senyawa Molekul
Teori Menurut Bronsted-Lowry
Asam ialah proton donor, sedangkan basa adalah proton akseptor.
Teori asam basa dari Arrhenius ternyata tidak dapat berlaku untuk semua pelarut, karena khusus untuk pelarut air. Begitu juga tidak sesuai dengan reaksi penggaraman karena tidak semua garam bersifat netral, tetapi ada juga yang bersifat asam dan ada yang bersifat basa.
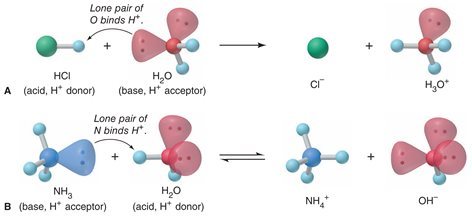
Konsep asam basa yang lebih umum diajukan oleh Johannes Bronsted, basa adalah zat yang dapat menerima proton. Ionisasi asam klorida dalam air ditinjau sebagai perpindahan proton dari asam ke basa.
HCl + H 2 O –> H 3 O + + Cl –
Demikian pula reaksi antara asam klorida dengan amoniak, melibatkan perpindahan proton dari HCl ke NH 3 .
HCl + NH 3 ⇄ NH 4 + + Cl –
Ionisasi asam lemah dapat digambarkan dengan cara yang sama.
HOAc + H 2 O ⇄ H 3 O + + OAc –
Pada tahun 1923 seorang ahli kimia Inggris bernama T.M. Lowry juga mengajukan hal yang sama dengan Bronsted sehingga teori asam basanya disebut Bronsted-Lowry. Perlu diperhatikan disini bahwa H + dari asam bergabung dengan molekul air membentuk ion poliatomik H 3 O + disebut ion Hidronium. Reaksi umum yang terjadi bila asam dilarutkan ke dalam air adalah:
HA + H 2 O ⇄ H 3 O + + A –
Penyajian ini menampilkan hebatnya peranan molekul air yang polar dalam menarik proton dari asam.
Perhatikanlah bahwa asam konjugasi terbentuk kalau proton masih tinggal setelah asam kehilangan satu proton. Keduanya merupakan pasangan asam basa konjugasi yang terdi dari dua zat yang berhubungan satu sama lain karena pemberian proton atau penerimaan proton. Namun demikian disosiasi asam basa masih digunakan secara Arrhenius, tetapi arti yang sebenarnya harus kita fahami
Johannes N. Bronsted dan Thomas M. Lowry membuktikan bahwa tidak semua asam mengandung ion H + dan tidak semua basa mengandung ion OH – .
Bronsted – Lowry mengemukakan teori bahwa asam adalah spesi yang memberi H + ( donor proton ) dan basa adalah spesi yang menerima H + (akseptor proton). Jika suatu asam memberi sebuah H + kepada molekul basa, maka sisanya akan menjadi basa konjugasi dari asam semula. Begitu juga bila basa menerima H + maka sisanya adalah asam konjugasi dari basa semula. Teori Bronsted – Lowry jelas menunjukkan adanya ion Hidronium (H 3 O + ) secara nyata.
HF merupakan pasangan dari F – dan H 2 O merupakan pasangan dari H 3 O + . Air mempunyai sifat ampiprotik karena dapat sebagai basa dan dapat sebagai asam.
HCl + H 2 O –> H 3 O + + Cl –
Asam Basa
NH 3 + H 2 O ⇄ NH 4 + + OH –
Manfaat dari teori asam basa menurut Bronsted – Lowry adalah sebagai berikut:
- 1. Aplikasinya tidak terbatas pada pelarut air, melainkan untuk semua pelarut yang mengandunh atom Hidrogen dan bahkan tanpa pelarut.
- 2. Asam dan basa tidak hanya berwujud molekul, tetapi juga dapat berupa anion dan kation.
Contoh lain:
- HAc(aq) + H 2 O(l) –> H 3 O+(aq) + Ac – (aq)
asam-1 basa-2 asam-2 basa-1
HAc dengan Ac – merupakan pasangan asam-basa konyugasi.
H 3 O+ dengan H 2 O merupakan pasangan asam-basa konyugasi. - H 2 O(l) + NH 3 (aq) –> NH 4 + (aq) + OH – (aq)
asam-1 basa-2 asam-2 basa-1
H 2 O dengan OH – merupakan pasangan asam-basa konyugasi. NH 4 + dengan NH 3 merupakan pasangan asam-basa konyugasi.
Pada contoh di atas terlihat bahwa air dapat bersifat sebagai asam (proton donor) dan sebagai basa (proton akseptor). Zat atau ion atau spesi seperti ini bersifat ampiprotik (amfoter).
Baca Juga Artikel Yang Mungkin Berhubungan : √ Pengertian Mikrobiologi Dalam Biologi Dan Faktor Beserta Mekanismenya
Klasifikasi Larutan Basa
Sama halnya dengan zat asam, zat basa juga dapat dengan mudah kita temui dalam kehidupan sehari-hari. Sifat licin dan rasanya yang pahit merupakan cara mudah untuk mengenali zat basa. Beberapa contoh zat basa yang sering digunakan adalah:
- Natrium hidroksida / soda api / soda ash dan kalium hidroksida, sebagai bahan baku pembersih dalam rumah tangga, misalnya sabun mandi, sabun cuci, detergen, pemutih dan pembersih lantai
- Magnesium hidroksida dan aluminium hidroksida, terkandung dalam obat nyeri lambung (antasid)
- Amoniak, untuk pelarut desinfektan (pencegah terjadinya infeksi) dan bahan baku pupuk urea
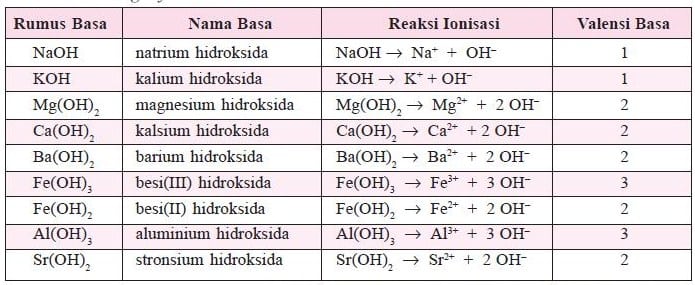
Sama seperti asam, basa juga dibedakan menjadi basa kuat dan basa lemah. Kekuatan suatu basa dapat ditentukan dari kemampuannya melepaskan ion hidroksida yang bermuatan negatif (ion OH–) ketika dilarutkan dalam air. Semakin banyak ion OH– yang dilepaskan, semakin kuat sifat basanya. Semua rumus kimia basa umumnya mengandung gugus OH–.
Seperti halnya dengan larutan asam, berdasarkan kemampuannya terurai menjadi ion OH- dalam air, larutan basa dapat dibedakan menjadi dua macam yakni, Larutan Basa Kuat dan Larutan basa Lemah
Titrasi asam kuat basa kuat merupkan metode penentuan kadar larutan asam kuat dengan zat peniter (penitrasi) suatu larutan basa kuat, atau penentuan kadar larutan basa kuat dengan zat peniter (penitrasi) suatu larutan asam kuat. Titik akhir titrasi adalah kondisi pada saat terjadi perubahan warna dari indikator. Titik akhir titrasi diharapkan mendekati titik ekuivalen titrasi, yaitu kondisi pada saat larutan asam kuat tepat bereaksi dengan larutan basa kuat.
Pada proses titrasi asam kuat dengan basa kuat dan sebaliknya, kedua larutan dapat terionisasi dengan sempurna. Hal ini dikarenakan oleh larutan asam kuat dan basa kuat termasuk ke dalam larutan elektrolit kuat yang dapat terionisasi secara sempurna di dalam air. Sehingga, garam yang tercipta pada reaksi ini memiliki sifat netral.
Oleh karena itu, pada proses titrasi asam kuat dengan basa kuat titik ekivalennya adalah ketika pH campuran sama dengan 7 (netral).
- Larutan basa kuat
ialah basa yang bila dilarutkan dalam air sebagian atau. seluruh molekulnya terionisasi menjadi ion OH-.
Konsep Garam dari Asam kuat dan basa kuat
Larutan garam ini bersifat netral. Sebagai contoh, reaksi netralisasi antara NaOH dan HCl menghasilkan garam NaCl. Di dalam air, NaCl terionisasi sempurna menghasilkan ion Na+ dan Cl-
NaOH(aq) + HCl(aq) = NaCl(aq) + H2O(l)
Basa asam netral
Kuat kuat
NaCl = Na+ + Cl-
Ion Na+ berasal dari basa kuat dan ion Cl- juga berasal dari asam kuat, jadi kedua ion tersebut merupakan asam dan basa Bronsted-Lowry lemah sehingga keduannyatidak bereaksi dengan air (tidak terhidrolisis). Oleh karena itu larutan bersifat netral atau pH=7
Larutan basa lemah
Yakni basa yang hanya sebagian molekulnya yang terurai menjadi ion OH-. Konsep Larutan garam yang berasal dari asam kuat dan basa lemah ini bersifat asam. Sebagai contoh adalah NH4Cl, garam ini terbentuk dari hasil reaksi netralisasi antara NH3 dan HCl dan di dalam air terinonisasi sempurna menghasilkan ion NH4+ dan Cl.
NH3(aq) + HCl(aq) = NH4Cl(aq)
Basa asam kuat asam
Lemah
NH4Cl(aq) = NH4(aq)+ Cl(aq)
Ion Cl berasal dari asam kuat, merupakan basa Bronsted-Lowry lemah sehingga tidak bereaksi dengan air(tidak mampu menarik ion H+), sedangkan ion NH+ berasal dari basa lemah, jadi merupakan asam Bronsted-Lowry kuat sehingga dapat bereaksi dengan air( terhidrolisis) atau memberikan ion H+ kepada air.
NH4+(aq) + H2O === NH3(aq) H3O+(l)
Karena ion NH4+ dapat memberikan ion H+ kepada air maka larutan menjadi bersifat asam dan diketahui harga Ka dari kesetimbangan di atas adalah 5,6 x 10-10. Penentuan pH
Contoh
Jika diketahui 0,1 M NH4Cl dan Kb NH3= 1,8x 10-5, maka Di dalam air garam NH4Cl terionisasi sempurna dengan persamaan reaksi berikut:
NH4Cl(aq) = NH4+(aq) + Cl-(aq)
Karena koefisien NH4Cl dan NH4+ sama maka [NH4+]=[NH4Cl]= 0,1 M Ion NH4+ mengalami hidrolisis sebagai berikut,
NH4(aq)+ + H2O(l) === NH3(aq) + H3O+(aq)
Persamaan tetapan hidolisisnya adalah sebagai berikut,
Kh = [NH3][H3O+]
[NH4+]
Baca Juga Artikel Yang Mungkin Berhubungan : 6 Perbedaan Senyawa Polar Dengan Non Polar
Macam Macam Basa
Kekuatan basa dipengaruhi oleh banyaknya ion – ion OH– yang dihasilkan oleh senyawa basa dalam larutannya. Berdasarkan banyak sedikitnya ion OH yang dihasilkan, larutan basa juga dibedakan menjadi dua macam sebagai berikut.
-
Basa Kuat
- Basa kuat yaitu senyawa basa yang dalam larutannya terion seluruhnya menjadi ion-ionnya. Reaksi ionisasi basa kuat merupakan reaksi berkesudahan.
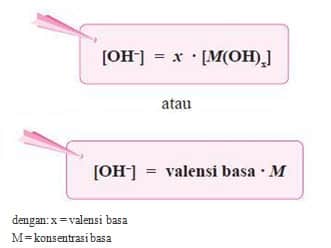
- Secara umum, ionisasi basa kuat dirumuskan sebagai berikut.
M(OH)x(aq) ⎯⎯→ Mx+(aq) + x OH–(aq)
-
Basa Lemah
- Basa lemah yaitu senyawa basa yang dalam larutannya hanya sedikit terionisasi menjadi ion-ionnya.
- Reaksi ionisasi basa lemah juga merupakan reaksi kesetimbangan.
- Secara umum, ionisasi basa lemah valensi satu dapat dirumuskan sebagai berikut.
M(OH)(aq) ←⎯⎯⎯⎯→ M+(aq) + OH–(aq)
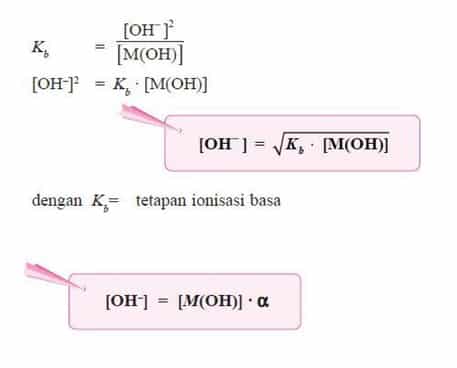
- Makin kuat basa maka reaksi kesetimbangan basa makin condong ke kanan, akibatnya Kb bertambah besar.
- Oleh karena itu, harga Kb merupakan ukuran kekuatan basa, makin besar Kb makin kuat basa.
- Berdasarkan persamaan di atas, karena pada basa lemah [M+] = [OH–], maka persamaan di atas dapat diubah menjadi:
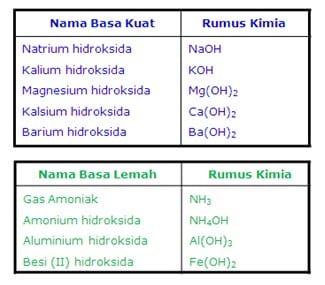
Contoh Basa kuat :
- Litium hidroksida (LiOH)
- Natrium hidroksida (NaOH)
- Kalium hidroksida (KOH)
- Kalsium hidroksida (Ca(OH)2)
- Rubidium hidroksida (RbOH)
- Stronsium hidroksida (Sr(OH)2)
- Sesium hidroksida (CsOH)
- Barium hidroksida (Ba(OH)2)
- Magnesium hidroksida (Mg(OH)2)
- Berilium hidroksida Be(OH)2)
Contoh Basa lemah :
- Amonium hidroksida (NH4OH)
- Aluminium hidroksida (Al(OH)3)
- Besi (III) hidroksida (Fe(OH)3)
- Amoniak (NH3)
- Besi (II) hidroksida (Fe(OH)2)
- Karbosium hidroksida (CA(OH)3)
- Nikel hidroksida (Ni(OH)2)
- Seng hidroksida (Zn(OH)2)
- Kadmium hidroksida (Cd(OH)2)
- Bismut hidroksida (Bi(OH)3)
- Perak hidroksida (Ag(OH))
- Emas (I) hidroksida (Au(OH))
- Emas (III) hidroksida (Au(OH)3)
- Tembaga (I) hidroksida (Cu(OH)2)
- Tembaga (II) hidroksida (Cu(OH))
- Raksa (I) hidroksida (Hg(OH))
- Raksa (II) hidroksida (Hg(OH)2)
- Timah (II) hidroksida (Sn(OH)2)
- Timah (IV) hidroksida (Sn(OH)4)
- Timbal (II) hidroksida (Pb(OH)2)
- Mangan hidroksida (Mn(OH)2)
- Kobalt (III) hidroksida (Co(OH)3)
- Kobalt (II) hidroksida (Co(OH)2)
- Anilia (C6H5NH2)
- Dimetilamina ((CH3)2NH)
- Hidrasim (H2NNH2)
- Hidroksilamida (HONH2)
- Metilamina (CH3NH2)
- Urea (H2NCONH2)
- Glukosa (C6H2O6)
- Metil hidroksida (CH3OH)
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Senyawa Polifenol pada Tanaman
Ciri Larutan Basa
Basa adalah zat yang dapat menetralkan asam. Secara kimia asam dan basa saling berlawanan. Basa yang larut dalam air disebut alkali.
berdasarkan kekuatannya, basa dibedakan menjadi basa lemah dan basa kuat. Makin kecil besar nilai pH-nya, maka semakin kuat basa tersebut. Aku ralat juga yang ini.. Basa lemah memiliki pH sekitar 9 – 11, sedangkan basa kuat memiliki pH dari 12 hingga 14.
- PH-nya lebih dari 7
- Membuat kertas lakmus merah menjadi kertas lakmus biru (perubahan warna)
- Bersifat pahit
- Korosif terhadap kulit
Contoh :
KOH + H2O K+ + OH–
CaOH + H2O Ca+ + OH–
Beberapa basa yang dapat kita jumpai dalam kehidupan sehari-hari adalah:
| Nama Basa | Rumus Kimia | Contoh Bahan |
| Aluminium hidroksida
Kalsium hidroksida Natrium hidroksida Kalium hidroksida Magnesium hidroksida |
AlOH3
CaOH2 NaOH KOH Mg(OH)2 |
Deodorant
Plaster Bahan sabun, pembersih saluran air Bahan sabun Obat maag |
Sifat Larutan Basa
Basa (alkali) berasal dari bahasa Arab yang berarti abu. Salah satu definisi basa adalah zat yang jika dilarutkan di dalam air akan menghasilkan ion hidroksida (OH–).
Indikator awalnya diperoleh dari tumbuhan, tetapi kini sudah dibuat di pabrik. Lakmus sebagai contoh, diperoleh dari liken, suatu simbiosis dari jamur dan alga. Selain liken berbagai jenis tumbuhan berwarna dapat digunakan sebagai indikator asam-basa. Misalnya mahkota bunga, kol merah, dan bit.
Tingkat keasaman (pH)
Larutan asam mempunyai tingkat keasaman yang berbeda-beda. Perbedaan tingkat keasaman dapat terjadi karena perbedaan kepekatannya. Tingkat keasaman lazim dinyatakan dengan skala pH. Skala pH berkisar dari 0 hingga 14 dengan ketentuan sebagai berikut:
- Larutan asam mempunyai pH < 7
- Larutan basa mempunyai pH > 7
- Larutan netral mempunyai pH = 7
Jadi semakin asam suatu larutan, semakin kecil pH-nya. Larutan dengan pH=1 memiliki sifat 10 kali lebih asam daripada larutan dengan pH=2.
Ion hidroksida mempunyai muatan negatif (makanya dikasih tanda minus (-) disebelah atas belakang OH). Basa adalah lawan dari asam. Secara umum, Basa memiliki sifat sebagai berikut:
- Rasa pahit jika dilarutkan dalam air (hanya untuk basa lemah)
- Sentuhan : terasa licin seperti sabun bila disentuh (hanya untuk basa lemah)
- Bersifat kaustik (dapat merusak jaringan kulit/iritasi)
- Hantaran listrik : dapat menghantarkan listrik (merupakan larutan elektrolit)
- Derajat keasaman (pH) lebih besar dari 7
- Mengubah warna lakmus menjadi berwarna biru
- Dalam keadaan murni umumnya berupa kristal padat
- dapat mengemulsi minyak
Baca Juga Artikel Yang Mungkin Berhubungan : Senyawa : Pengertian, Ciri, Sifat, Dan Macam Beserta Contohnya Secara Lengkap
Contoh Larutan Basa
Beberapa contoh basa yang digunakan dalam kehidupan sehari-hari sebagai berikut:
- Soda api (natrium hidroksida NaOH) berfungsi untuk melarutkan lemak dan minyak sehingga dapat digunakan untuk membuka saluran bak cuci yang mampat.
- Kalsium hidroksida atau kapur (Ca(OH)2) digunakan untuk kapur sirih dan sebagai bahan bangunan, yaitu campuran adukan semen
- Amonia (larutan NH3) digunakan dalam pembersih muka atau pembersih kaca
- Asam dalam Tubuh
Basa kehidupan sehari-hari
- soda api (natrium hidroksida, NaOh), berfungsi untuk :
– Melarutkan lemak dan minyak
– membersihkan oven
– menghancurkan seloluse
- Kalsium hidroksida atau kapur (Ca(OH)
- Amonia ( larutan NH3) digunakan secagai pembersih kaca.
Indikator
Cara untuk mengetahui apakah suatu zat tergolong asam atau basa adalah menggunakan indikator.
Indikator adalah merupakan zat yang dapat berupah warna bila dimasukkan kedalam senyawa asam atau basa. Indikatar dapat berupa kertas atau larutan, indicator berupa kertas adalah kertas lakmus.
Ada dua macam kertas lakmus, yaitu lakmus berwarna merah dan lakmus berwarna biru. Cara pemakaiannya adalah kertas lakmus dimasukkan kedalam senyawa, kemudian dilihat perubahan warnanya.
Suatu senyawa tergolong asam bila kertas lakmus biru berubah warna menjadi merah, tetapi kertas lakmus merah tidak berubah warna.. sementara kalau senyawa golongan basa bila kertas lakmus merah berubah warna menjadi biru, tetapi kertas lakmus biru tidak berubah warna. Bila senyawa tidak mengubah warna kertas lakmus digolongkan bukan senyawa asam atau basa atau senyawa netral.
-
Hujan Asam
Air hujan biasanya bersifat asam dengan pH sekitar 6. Hal ini dikarenakan air hujan bercampur dengan karbon dioksida di udara menghasilkan asam karbonat. Nah, kalo pH air hujan kurang dari 5,6.. fenomena ini disebut hujan asam.
Hujan asam terjadi karena udara tercemar oleh zat-zat (oksida) yang bersifat asam, terutama oksida belerang (SO2 dan SO3) dan oksida nitrogen (NO2).
Oksida belerang adalah hasil pembakaran bahan bakar fosil terutama batu bara, dan industri pengolahan logam. sedangkan Oksida nitrogen berasal dari asap kendaraan bermotor dan asap industri.
Hujan asam menimbulkan kerugian karena dapat mengganggu keseimbangan ekosistem, mengurangi kesuburan tanah, merusak bangunan terutama yang terbuat dari logam dan batuan karbonat (pualam), membunuh makhluk hidup di air, dan merusak hutan karena pH tanah yang terlalu asam dapat mengakibatkan tumbuhan mati. pH tanah berkisar antara 4 hingga 8, tetapi kebanyakan antara 6,5 hingga 7,5. Di tanah kapur biasanya lebih bersifat basa, sedangkan di tanah berpasir atau gambut (rawa) dan tanah liat biasanya lebih bersifat asam. Tanah yang subur biasanya ada pada rentang 6,5 hingga 7,5.
-
Asam di Laboratorium
sangat banyak jenis asam yang digunakan di laboratorium, baik laboratorium sekolah, kampus, maupun laboratorium perusahaan dan penelitian. Diantaranya adalah..
-
Basa dalam Tubuh Manusia
Coba tebak! dimanakah keberadaan asam dalam tubuh kita? Kalo yang bilang ada di lambung, jawaban kamu betul! Yay.. asam lambung adalah HCl (asam klorida) yang sama dengan yang kamu pake buat praktikum kemarin. pH-nya 1-2.. asam kuat! kenapa sih tubuh kita perlu ada asam lambung yang pH-nya kuat?
Inget kan gimana HCl bisa larutin lempeng logam Aluminium sampe habis? Kan serem ya kalo ntar lambung kita jadi bolong.
Normalnya, asam lambung berfungsi untuk membunuh bakteri yang masuk barengan makanan yang kalian makan. Allah itu Mahabaik, tau banget kalo kita ini sering makan sembarangan. Lupa cuci tangan lah.. makan dipinggir jalan banyak debu lah.. apa lah.. pasti banyak bakteri yang masuk ke perut lewat makanan-makanan itu. Nah.. asam lambung (HCl) ini yang akan menetralisir semuanya.. membunuh bakteri yang masuk! Apalagi kalo ketelen seng *amit-amit*.. tapi tenang… asam lambung akan menetralkannya
Asam lambung juga bisa menciptakan kondisi yang sesuai buat pencernaan protein. Jadi dalam proses pencernaan protein, enzim yang ngerjain prosesnya ini cuma mau kalo kondisi asam di dalem lambungnya udah pas, baru dia mau kerja mencerna protein.
kalian udah pake NaOH dalam praktikum kan? sebetulnya manfaat NaOH dalam kehidupan sehari-hari sangat banyak. NaOH dikenal dengan istilah soda api. NaOH merupakan bahan baku dalam pembuatan sabun karena ia dapat melarutkan lemak menjadi senyawa sabun. Reaksi pembuatan sabun ini disebut penyabunan atau saponifikasi.
Soda api juga dimanfaatkan untuk mencuci saluran bak cuci dan membuka saluran toilet yang mampat tertutup bahan kertas atau tisu, karena soda api dapat menghancurkan selulosa yang merupakan bahan dasar kertas dan tisu. Soda api juga biasa digunakan untuk membersihkan oven (pemanggang). Soda api di industri juga banyak dipake dalam pembuatan kertas dan rayon sebagai pemutih.
Selanjutnya adalah kalsium hidroksida Ca(OH)2 atau kapur. Kapur biasanya dipake nenek-nenek buat nyirih dan bahan bangunan campuran semen. Ayo kamu coba cari tau, kenapa nenek-nenek suka nyirih?? hehehe. Kapur juga dipake buat menetralkan tanah yang tercemar oleh hujan asam.
Contoh lain adalah amonia (NH3) yang sering digunakan dalam pembersih wajah atau pembersih kaca. Kenapa? karena basa amonia adalah basa lemah. Ingat sifat basa yang dapat melarutkan lemak.