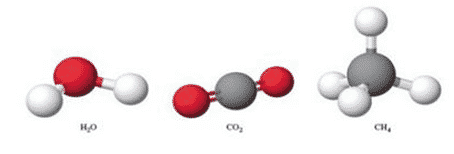
Untuk hal ini molekul merupaka suatu agregar “kumpulan” yang terdiri dari sedikitnya dua atom dalam susunan tertentu yang terkait bersama oleh ikatan kimia.
Pengertian Senyawa Molekul
Senyawa molekul adalah atom dihubungkan bersama dengan berbagai elektron, pada dasarnya mereka mengikat bersama-sama pada netral partikel elektrik yang disebut molekul.
Struktur Senyawa Molekul
Molekul dibentuk oleh 2(dua) atau lebih atom. Molekul dapat didefinisikan sebagai kelompok atom yang terikat dengan kuat, dengan ikatan antar kelompok atomsejenis yang relatif lemah. Sebuah molekul dapat terdiri atom-atom yang berunsur sama (misalnya oksigen O2), ataupun terdiri dari unsur-unsur berbeda (misalnya air H2O). Atom-atom dan kompleks yang berhubungan secara non-kovalen (misalnya terikat oleh ikatan hidrogen dan ikatan ion) secara umum tidak dianggap sebagai satu molekul tunggal.
Baca Juga : Biologi Molekul – Pengertian, Teknik, Ilmu, Sejarah, Ukuran, Rumus, Geometri
Dalam setiap molekul, atom-atom terikat oleh gaya tarik-menarik yang kuat, biasanya berbentuk ikatan primer . Sebaliknya , ikatan antar molekul adalah lemah karenanya dalam batas-batas tertentu setiap molekul dapat bergerak dengan bebas. Molekul didefinisikan sebagai sekelompok atom (paling sedikit dua) yang saling berikatan dengan sangat kuat (kovalen) dalam susunan tertentu dan bermuatan netral serta cukup stabil. Menurut definisi ini, molekul berbeda dengan ion poliatomik. Dalam kimia organik danbiokimia, istilah molekul digunakan secara kurang kaku, sehingga molekul organik dan biomolekulbermuatan pun dianggap termasuk molekul.
Dalam teori kinetika gas, istilah molekul sering digunakan untuk merujuk pada partikel gas apapun tanpa bergantung pada komposisinya. Menurut definisi ini, atom-atom gas muliadianggap sebagai molekul walaupun gas-gas tersebut terdiri dari atom tunggal yang tak berikatan.
Hal ini disimpulkan dari pengamatan bahwa
- Setiap senyawa molekul memiliki titik cair dan titik didih yang lebih rendah dibandingkan dengan bahan padatnya.
- Benda padat molekular lebih lunak karena setiap molekul dapat bergeser satu dengan lainnya oleh tegangan yang kecil saja.
- Molekul-molekul tetap utuh dalam keadaan cair ataupun gas
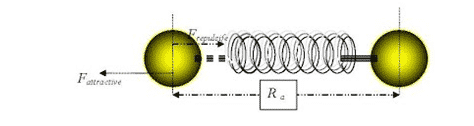
Jika 2 atom (atau molekul) mendekati satu sama lainnya, maka akan bekerja pada masing-masing atom (atau molekul) tersebut yaitu gaya tarik ataupun gaya tolak. Model paling sederhana diberikan ilustrasi dibawah ini :
Dalam posisi setimbang, atom-atom berada pada jarak pisah tertentu yang disebut sebagai jarak atom atau panjang ikatan. Atom dikatakan dalam posisi setimbang, jika berada dalam keadaan energi bebas (E) yang sangat minimum (paling stabil).
Unsur-unsur penyusun senyawa tersebut. Sebagai contohnya, air selalu memiliki nilai perbandingan atom hidrogen berbanding oksigen 2:1. Etanol pula selalu memiliki nilai perbandingan antara karbon, hidrogen, dan oksigen 2:6:1. Namun, rumus ini tidak menunjukkan bentuk ataupun susunan atom dalam molekul tersebut. Contohnya, dimetil eter juga memiliki nilai perbandingan yang sama dengan etanol. Molekul dengan jumlah atom penyusun yang sama namun berbeda susunannya disebut sebagai isomer.
Perlu diperhatikan bahwa rumus empiris hanya memberikan nilai perbandingan atomatom penyusun suatu molekul dan tidak memberikan nilai jumlah atom yang sebenarnya. Rumus molekul menggambarkan jumlah atom penyusun molekul secara tepat. Contohnya, asetilena memiliki rumus molekuler C2H2 , namun rumus empirisnya adalah CH. Massa suatu molekul dapat dihitung dari rumus kimianya. Sering kali massa molekul diekspresikan dalam satuan massa atom yang setara dengan 1/12 massa atom karbon 12.
Contoh Senyawa Molekul
molekul-molekul gas karbon dioksida termasuk molekul senyawa karena tersusun atas atom-atom dari unsur yang berbeda, yaitu satu atom karbon dan dua atom oksigen (rumus CO2).
Contoh zat yang partikel terkecilnya merupakan molekul senyawa adalah air. Air yang biasa kita minum mengandung partikel-partikel terkecil yang disebut molekul air. Molekul air ini tersusun atas dua atom unsur hidrogen dan satu atom unsur oksigen (rumus H2O).
Baca Juga : Senyawa Polar Dan Non Polar – Pengertian, Ciri, Kovalen, Perbedaan, Sifat, Titik Didih, Contoh
Karena molekul air tersusun dari atom-atom unsur yang berbeda maka molekul air termasuk molekul senyawa. Molekul air dapat dihasilkan dari reaksi antara molekul unsur hidrogen dan molekul unsur oksigen.
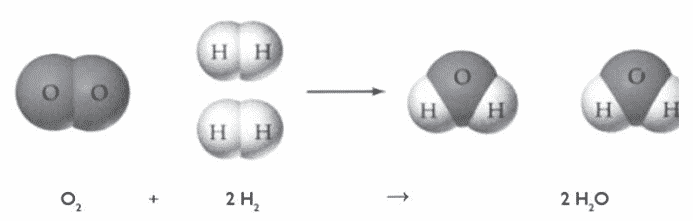
Pada Gambar di atas, terlihat bahwa molekul unsur hidrogen bereaksi dengan molekul unsur oksigen membentuk molekul senyawa air. Tiap molekul unsur oksigen akan bereaksi dengan dua molekul unsur hidrogen membentuk 2 molekul senyawa air.
Jika satu molekul oksigen memerlukan dua molekul unsur hidrogen agar bereaksi sempurna membentuk 2 molekul senyawa air maka 2 molekul unsur oksigen memerlukan 4 molekul unsur hidrogen agar bereaksi sempurna membentuk 4 molekul air.
Pada reaksi tersebut terlihat bahwa dalam reaksi kimia tidak ada kehilangan atom-atom. Jumlah atom H dan O di sebelah kanan sama dengan jumlah atom H dan O di sebelah kiri.
Perbedaannya, yaitu masing-masing atom yang di sebelah kiri berikatan dengan atom dari unsur yang sama, sedangkan di sebelah kanan sudah berikatan dengan atom dari unsur lain membentuk molekul senyawa.
Jumlah atom pada suatu reaksi akan tetap sehingga fenomena adanya Hukum Kekekalan Massa (jumlah massa zat-zat yang bereaksi sama dengan jumlah massa zat-zat hasil reaksi) dapat dipahami.
Selain zat-zat yang telah disebutkan di atas, masih banyak zat-zat di sekitar kita yang partikel terkecilnya berupa molekul senyawa.
Contohnya adalah gula putih (C12H22O11) yaitu zat yang biasa menjadi campuran untuk membuat kopi. Contoh lainnya adalah gas karbon monoksida (CO) dan etanol (C2H5OH).
Karbon monoksida adalah gas yang dapat meracuni darah kita sehingga menimbulkan kematian. Adapun etanol yaitu zat yang bisa dipakai untuk berbagai keperluan, seperti sterilisasi, campuran minuman keras, dan bahan bakar. Semua zat tersebut tersusun atas partikel-partikel terkecil materi yang disebut molekul.
Pengertian Senyawa Ionik
Ion adalah atom atau sekumpulan atom yang bermuatan listrik. Ion bermuatan negatif, yang menangkap satu atau lebih elektron, disebut anion, karena dia tertarik menuju anoda. Ion bermuatan positif, yang kehilangan satu atau lebih elektron, disebut kation, karena tertarik ke katoda. Proses pembentukan ion disebut ionisasi. Atom atau kelompok atom yang terionisasi ditandai dengan tikatas n+ atau n-, di mana n adalah jumlah elektron yang hilang atau diperoleh.
Baca Juga : Pengertian Ionisasi, Disosiasi Dan Eksitasi Beserta Contohnya
Sejarah Ion
Ion pertama kali disajikan dalam bentuk teori oleh Michael Faraday pada sekitar tahun 1830, untuk menggambarkan mengenai bagian melekul yang bergerak ke arah anoda atau katoda dalam suatu tabung hampa udara (vacuum tube, CRT). Namun, mekanisme peristiwa ini baru dideskripsikan pada 1884 oleh Svante August Arrhenius dalam disertasi doktornya di University of Uppsala. Pada mulanya, teori ini tidak diterima (ia memperoleh gelarnya dengan nilai minimum), tetapi kemudian disertasinya memenangi Hadiah Nobel Kimia pada tahun 1903.
Jenis-Jenis Ion
Berikut ini adalah jenis-jenis dari ion, sebagai berikut:
- Ion Positif (Kation)
Ion positif merupakan atom yang telah melepas electron, ion ini kebanyakan berasal dari logam atau unsur dengan electron valensi kurang dari 4, namun ada ion hydrogen H+ yang merupakan ion positif yang berasal dari non logam. Kecenderungan atom untuk membentuk ion positif sangat kuat pada golongan IA. Atom fransium (Fr) merupakan atom paling mudah membentuk ion positif, dan letaknya memang di golongan IA.
Contoh pembentukan ion positif adalah sebagai berikut :
11Na memiliki konfigurasi 2, 8, 1. Elektron terluar 1 membuatnya kurang stabil, sehingga untuk menuju ke posisi stabil (konfigurasi 2,8 sehingga sama dengan gas mulia) atom Na akan melepas sebuah elektron membentuk ion Na+.
Na 1e + Na+
- Ion Negatif (anion)
Berlawanan dengan ion positif, Ion negative merupakan atom yang telah menangkap electron. Ion ini berasal dari non logam atau atom yang berelektron valensi lebih dari 4. Kecenderungan membentuk ion negative sangat kuat pada golongan VIIA. Unsur Fluorin (F) yang letaknya di VIIA merupakan atom yang paling mudah menangkap electron sehingga paling mudah membentuk ion negative.
Contoh pembentukan ion negative adalah sebagai berikut :
17Cl memiliki konfigurasi 2, 8, 7. Elektron terluar adalah 7 membuatnya kurang stabil, sehingga untuk menuju stabil atom Cl akan menangkap 1 elektron (konfigurasi 2,8,8 sehingga akan sama dengan gas mulia) membentuk ion Cl− .
Cl + 1e Cl−
Ikatan Ion senyawa ion
Ikatan ion (ikatan elektrokovalen) : jenis ikatan kimia yang dapat terbentuk antara ion-ion logam dengan non-logam (atau ion poliatomik seperti amonium) melalui gaya tarik-menarik elektrostatik. Dengan kata lain, ikatan ion terbentuk dari gaya tarik-menarik antara dua ion yang berbeda muatan.
Baca Juga : Ikatan Ion : Pengertian, Ciri, Dan Syarat Terjadinya, Serta Contohnya Lengkap
Misalnya pada garam meja (natrium klorida). Ketika natrium (Na) dan klor (Cl) bergabung, atom-atom natrium kehilangan elektron, membentuk kation (Na+), sedangkan atom-atom klor menerima elektron untuk membentuk anion (Cl–). Ion-ion ini kemudian saling tarik-menarik dalam rasio 1:1 untuk membentuk natrium klorida.
Na + Cl → Na+ + Cl– → NaCl
Susunan Senyawa Ion
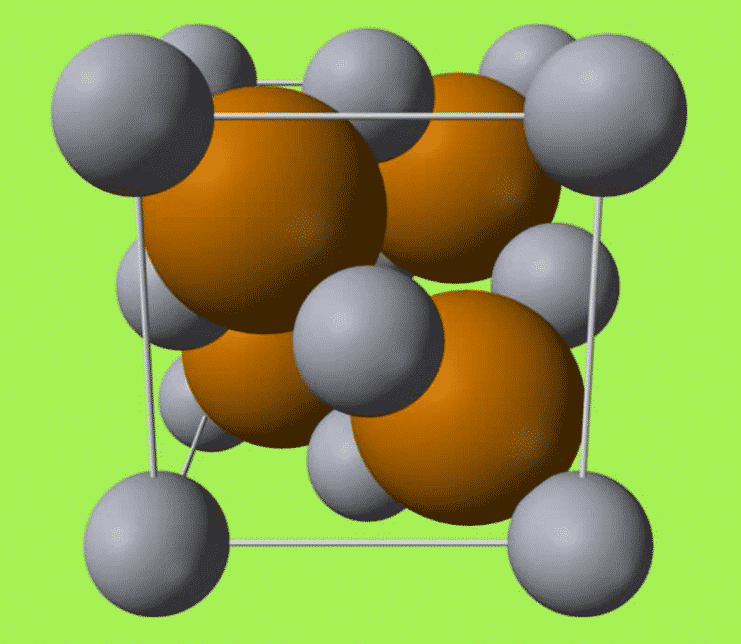
Aturan oktet menjelaskan bahwa dalam pembentukan natrium klorida, natrium akan melepas satu elektron sedangkan klorin akan menangkap satu elektron. Sehingga terlihat bahwa satu atom klorin membutuhkan satu atom natrium. Dalam struktur senyawa ion natrium klorida, ion positif natrium (Na+) tidak hanya berikatan dengan satu ion negatif klorin (Cl–) tetapi satu ion Na+ dikelilingi oleh 6 ion Cl– demikian juga sebaliknya. Struktur tiga dimensi natrium klorida dapat digunakan untuk menjelaskan susunan senyawa ion.
Sifat-Sifat Ionik
- bersifat polar
- larutannya dalam air menghantarkan arus listrik
- titik lelehnya tinggi
- lelehannya menghantarkan arus listrik
- larut dalam pelarut-pelarut polar
Perbedaan Antara Senyawa Ionik Dan Senyawa Molekul
Entalpi fusi “energi panas yang diserap bila padat mencair” dan entalpi penguapan “energi panas yang diserap ketika cairan mendidih” lebih tinggi dalam senyawa ion. Senyawa molekuler lebih mudah terbakar dibandingkan senyawa ion.
Senyawa molekuler yang lebih lembut dan lebih fleksibel dibandingkan dengan senyawa ion. Senyawa ionik memiliki titik leleh dan titik didih lebih tinggi dari senyawa molekul. Senyawa ionik bermuatan ion, sedangkan senyawa molekul terdiri dari molekul.
Baca Juga : Elektrolit Dan Non Elektrolit – Pengertian, Sejarah, Proses, Kuat, Lemah, Senyawa, Contoh
Suatu senyawa ionik dibentuk oleh reaksi dari logam dengan non-logam, sedangkan senyawa molekul biasanya dibentuk oleh reaksi dari dua atau lebih non-logam. Dalam senyawa ion, ion-ion yang diadakan bersama-sama karena daya tarik listrik, sedangkan dalam senyawa molekul, atom yang diselenggarakan bersama oleh daya tarik antar atom karena elektron bersama.
Senyawa molekul tidak dapat menghantarkan listrik di setiap keadaan, sedangkan senyawa ion, jika dilarutkan dalam larutan berair dapat bertindak sebagai konduktor listrik yang baik. Senyawa ionik lebih reaktif daripada senyawa molekuler.
Perebadaan di atas juga membantu membedakan dan mengidentifikasi apakah senyawa tertentu yang tidak diketahui ialah ionik atau molekul dengan melakukan tes yang sesuai di laboratorium dan mencari tahu perbedaan sifat kimia dan sifat fisik senyawa.
Daftar Pustaka:
- Kimbal,John W.1994. Biologi. Jilid 1,2, dan 3. Edisi kelima. Erlangga. Jakarta.
- Pearce, Evelyne.1997. Anatomi dan Fisiologi untuk Paramedis. PT Gramedia Pustaka Utama. Jakarta
- Poedjiadi, Anna. Dasar-Dasar Biokimia. Jakarta: UI-Press, 1994.
- Winarno, F. O. Kimia Pangan dan Gizi. Jakarta: Gramedia Pustaka Utama, 2004.