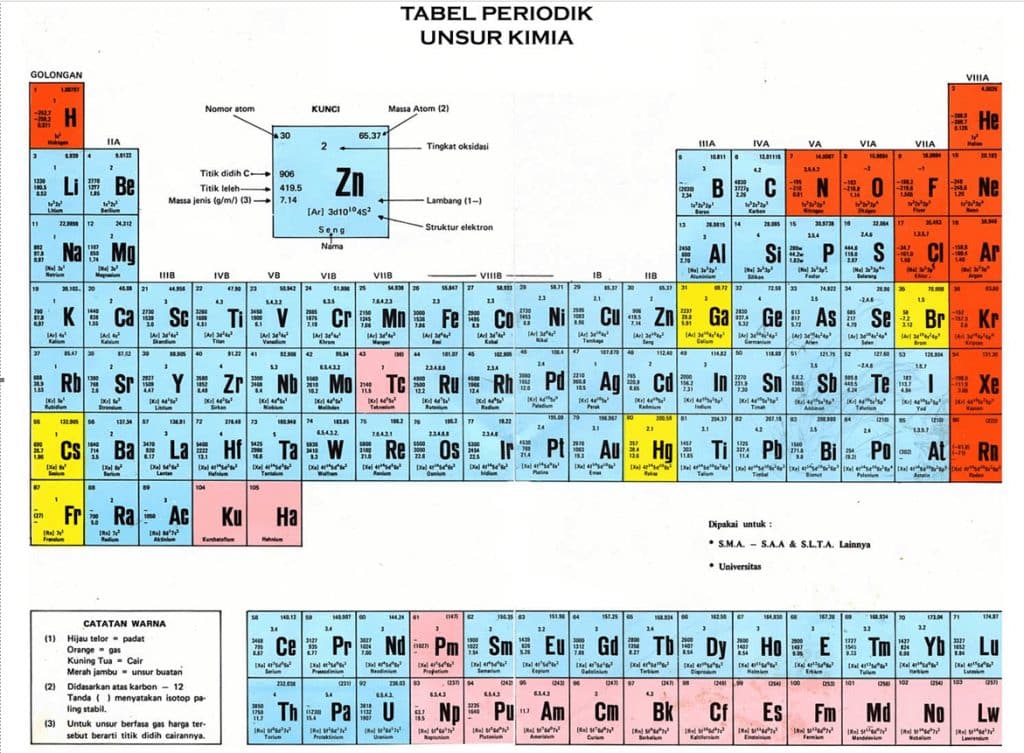
Apa itu Sistem Periodik Unsur ? Sistem periodik adalah suatu tabel berisi identitas unsur-unsur yang dikemas secara berkala dalam bentuk periode dan golongan berdasarkan kemiripan sifat-sifat unsurnya.
- Tabel Berkala adalah Penataan secara tabel dari unsur-unsur berdasarkan hukum berkala
- Periode adalah : lajur-lajur horizontal dalam sistem periodik
- Golongan adalah : kolom-kolom vertikal dalam sistem periodik
Baca Juga Artikel Yang Mungkin Berhubungan : Makalah Teori Indikator Asam Basa : Indikator, Ciri, Contoh Dan Fungsinya
Pengelompokan Unsur Unsur berdasarkan sifat kelogamannya
-
Unsur Logam
- Kerapatannya tinggi
- Padat (dapat ditempa/dibentuk)
- Bersifat konduktor
- Mengkilap
-
Unsur Non Logam
- Kerapatannya rendah
- Rapuh
- Bersifat isolator
- Tidak Mengkilap
Unsur kimia, adalah zat kimia yang tidak dapat dibagi lagi menjadi zat yang lebih kecil, atau tidak dapat diubah menjadi zat kimia lain dengan menggunakan metode kimia biasa.
Partikel terkecil dari unsure (Unsur Kimia) adalah atom. Sebuah atom terdiri atas inti atom (nukleus) dan dikelilingi oleh elektron. Inti atom terdiri atas sejumlah proton dan neutron. Hingga saat ini diketahui terdapat kurang lebih 117 unsur di dunia.
Baca Juga Artikel Yang Mungkin Berhubungan : Larutan Elektrolit : Pengertian, Ciri, Dan Jenis Beserta Contohnya Secara Lengkap
Gambar dan Keterangan Tabel Periodik
Keterangan
| No atom | Unsur Kimia | Simbol |
| 1 | hidrogen | H |
| 2 | helium | He |
| 3 | lithium | Li |
| 4 | beryllium | Be |
| 5 | boron | B |
| 6 | carbon | C |
| 7 | nitrogen | N |
| 8 | oxygen | O |
| 9 | fluorine | F |
| 10 | neon | Ne |
| 11 | sodium | Na |
| 12 | magnesium | Mg |
| 13 | aluminum | Al |
| 14 | silicon | Si |
| 15 | phosphorus | P |
| 16 | sulfur | S |
| 17 | chlorine | Cl |
| 18 | argon | Ar |
| 19 | potassium | K |
| 20 | calcium | Ca |
| 21 | scandium | Sc |
| 22 | titanium | Ti |
| 23 | vanadium | V |
| 24 | chromium | Cr |
| 25 | manganese | Mn |
| 26 | iron | Fe |
| 27 | cobalt | Co |
| 28 | nickel | Ni |
| 29 | copper | Cu |
| 30 | zinc | Zn |
| 31 | gallium | Ga |
| 32 | germanium | Ge |
| 33 | arsenic | As |
| 34 | selenium | Se |
| 35 | bromine | Br |
| 36 | krypton | Kr |
| 37 | rubidium | Rb |
| 38 | strontium | Sr |
| 39 | yttrium | Y |
| 40 | zirconium | Zr |
| 41 | niobium | Nb |
| 42 | molybdenum | Mo |
| 43 | technetium | Tc |
| 44 | ruthenium | Ru |
| 45 | rhodium | Rh |
| 46 | palladium | Pd |
| 47 | silver | Ag |
| 48 | cadmium | Cd |
| 49 | indium | In |
| 50 | tin | Sn |
| 51 | antimony | Sb |
| 52 | tellurium | Te |
| 53 | iodine | I |
| 54 | xenon | Xe |
| 55 | cesium | Cs |
| 56 | barium | Ba |
| 57 | lanthanum | La |
| 58 | cerium | Ce |
| 59 | praseodymium | Pr |
| 60 | neodymium | Nd |
| 61 | promethium | Pm |
| 62 | samarium | Sm |
| 63 | europium | Eu |
| 64 | gadolinium | Gd |
| 65 | terbium | Tb |
| 66 | dysprosium | Dy |
| 67 | holmium | Ho |
| 68 | erbium | Er |
| 69 | thulium | Tm |
| 70 | ytterbium | Yb |
| 71 | lutetium | Lu |
| 72 | hafnium | Hf |
| 73 | tantalum | Ta |
| 74 | tungsten | W |
| 75 | rhenium | Re |
| 76 | osmium | Os |
| 77 | iridium | Ir |
| 78 | platinum | Pt |
| 79 | gold | Au |
| 80 | mercury | Hg |
| 81 | thallium | Tl |
| 82 | lead | Pb |
| 83 | bismuth | Bi |
| 84 | polonium | Po |
| 85 | astatine | At |
| 86 | radon | Rn |
| 87 | francium | Fr |
| 88 | radium | Ra |
| 89 | actinium | Ac |
| 90 | thorium | Th |
| 91 | protactinium | Pa |
| 92 | uranium | U |
| 93 | neptunium | Np |
| 94 | plutonium | Pu |
| 95 | americium | Am |
| 96 | curium | Cm |
| 97 | berkelium | Bk |
| 98 | californium | Cf |
| 99 | einsteinium | Es |
| 100 | fermium | Fm |
| 101 | mendelevium | Md |
| 102 | nobelium | No |
| 103 | lawrencium | Lr |
| 104 | rutherfordium | Rf |
| 105 | dubnium | Db |
| 106 | seaborgium | Sg |
| 107 | Bohrium | Bh |
| 108 | Hassium | Hs |
| 109 | meitnerium | Mt |
| 110 | Darmstadtium | Ds |
| 111 | Roentgenium | Rg |
| 112 | Copernicium | Cn |
| 113 | Ununtrium | Uut |
| 114 | Ununquadium | Uuq |
| 115 | Ununpentium | Uup |
| 116 | Ununhexium | Uuh |
| 117 | Ununseptium | Uus |
| 118 | Ununoctium | Uuo |
Cara Membaca Tabel Periodik
Cara membaca tabel periodik ini ialah dengan menjumlahkan proton dan neutron di setiap atom unsur. Elektron tidak termasuk dalam massa atom. Elektron tidak berpengaruh banyak terhadap berat atom.
Unsur-unsur Proton dan Atom
- Tiap unsur atom di sisi kanan mengandung 1 proton lebih banyak daripada atom di sebelah kirinya.
- Unsur-unsur juga dipisahkan menjadi 3 kelompok, kamu dapat melihat pengelompokannya pada tabel.
- Contohnya, baris pertama mencantumkan hidrogen, yang memiliki nomor atom 1, dan helium, yang memiliki nomor atom 2.
Golongan Atom
- Golongan atom punya sifat fisik dan kimia yang sama.
- Golongan ditunjukkan oleh kolom vertikal.
- Golongan atom memiliki warna yang sama
- Setiap unsur pada golongan tertentu memiliki jumlah elektron yang sama pada orbital terluarnya.
- Sebagian besar unsur hanya masuk ke satu golongan.
Urutan Membaca Tabel Periodik
Cara membaca tabel periodic sesuai urutannya ialah sebagai berikut:
- Bacalah golongan atom mengikuti kolomnya dari atas ke bawah.
- Perhatikan ruang kosong pada tabel.
- Pertimbangkan sifat fisik dan kimia yang sama
- Perhatikan bahwa setiap baris disebut periode.
- Semua unsur dalam satu periode memiliki jumlah orbital atom yang sama.
- Bacalah periode unsur mengikuti barisnya dari kiri ke kanan.
- Bedakan antara logam, semilogam, dan nonlogam.
Cara Memahami Unsur dalam Tabel Periodik
Untuk membaca tabel periodik perlu dipahami dulu sifat-sifat unsur dengan mengenali jenis unsur tersebut. Sebagian besar tabel periodik menggunakan warna untuk menunjukkan perbedaan unsur. Perhatikan hal-hal berikut ini:
- Kelompok logam, semilogam, atau nonlogam memiliki warna yang beda.
- Unsur logam di kanan tabel
- Unsur nonlogam di sisi kiri
- Kelompok semilogam terletak di antara logam dan nonlogam.
Demikian paparan tentang cara membaca tabel periodik. Diperlukan ketelatenan dan kesabaran tinggi untuk membaca tabel ini. Semoga berhasil.
Apa Itu Tabel Periodik Unsur Kimia ?
Hal yang membedakan unsur satu dengan lainnya adalah “jumlah proton” dan jumah elektron suatu unsur atau ikatan dalam inti atom tersebut. Misalnya, seluruh atom karbon memiliki proton sebanyak 6 buah, sedangkan atom oksigen memiliki proton sebanyak 8 buah. Jumlah proton pada sebuah atom dikenal dengan istilah nomor atom (dilambangkan dengan Z).
Namun demikian, atom-atom pada unsur yang sama tersebut dapat memiliki jumlah netron yang berbeda; hal ini dikenal dengan sebutanisotop. Massa atom sebuah unsur (dilambangkan dengan “A”) adalah massa rata-rata atom suatu unsur pada alam.
Baca Juga Artikel Yang Mungkin Berhubungan : Campuran : Pengertian, Ciri, Dan Macam Serta Contohnya Dalam Ilmu Kimia
Karena massa elektron sangatlah kecil, dan massa neutron hampir sama dengan massa proton, maka massa atom biasanya dinyatakan dengan jumlah proton dan neutron pada inti atom, pada isotop yang memiliki kelimpahan terbanyak di alam. Ukuran massa atom adalah satuan massa atom (smu). Beberapa isotop bersifat radioaktif, dan mengalami penguraian (peluruhan) terhadap radiasi partikel alfa atau beta.
Lambang kimia Tabel Sistem Periodik Unsur Kimia
Sebelum kimia menjadi bidang ilmu, ahli alkemi telah menentukan simbol-simbol baik untuk logam maupun senyawa umum lainnya. Mereka menggunakan singkatan dalam diagram atau prosedur; dan tanpa konsep mengenai suatu atom bergabung untuk membentuk molekul. Dengan perkembangan teori zat, John Dalton memperkenalkan simbol-simbol yang lebih sederhana, didasarkan oleh lingkaran, yang digunakan untuk menggambarkan molekul.
Sistem yang saat ini digunakan diperkenalkan oleh Berzelius. Dalam sistem tipografi tersebut, simbol kimia yang digunakan adalah singkatan dari nama Latin (karena waktu itu Bahasa Latin merupakan bahasa sains); misalnya Fe adalah simbol untuk unsur ferrum (besi),Cu adalah simbol untuk unsur Cuprum (tembaga), Hg adalah simbol untuk unsur hydrargyrum (air raksa), dan sebagainya.
Baca Juga Artikel Yang Mungkin Berhubungan : Larutan Asam : Pengertian, Ciri, Dan Sifat Beserta Contohnya Secara Lengkap
Simbol kimia digunakan secara internasional, meski nama-nama unsur diterjemahkan antarbahasa. Huruf pertama simbol kimia ditulis dalam huruf kapital, sedangkan huruf selanjutnya (jika ada) ditulis dalam huruf kecil.
Tata nama
Penamaan unsur telah jauh sebelum adanya teori atom suatu zat, meski pada waktu itu belum diketahui mana yang merupakan unsur, dan mana yang merupakan senyawa. Ketika teori atom berkembang, nama-nama unsur yang telah digunakan pada masa lampau tetap dipakai. Misalnya, unsur “cuprum” dalam Bahasa Inggris dikenal dengan copper, dan dalam Bahasa Indonesia dikenal dengan istilah tembaga. Contoh lain, dalam Bahasa Jerman “Wasserstoff” berarti “hidrogen”, dan “Sauerstoff” berarti “oksigen”.
Nama resmi dari unsur kimia ditentukan oleh organisasi IUPAC. Menurut IUPAC, nama unsur tidak diawali dengan huruf kapital, kecuali berada di awal kalimat. Dalam paruh akhir abad ke-20, banyak laboratorium mampu menciptakan unsur baru yang memiliki tingkat peluruhan cukup tinggi untuk dijual atau disimpan.
Baca Juga Artikel Yang Mungkin Berhubungan : Termokimia : Pengertian, Sistem, Reaksi, Dan Rumus Serta Contohnya Lengkap
Nama-nama unsur baru ini ditetapkan pula oleh IUPAC, dan umumnya mengadopsi nama yang dipilih oleh penemu unsur tersebut. Hal ini dapat menimbulkan kontroversi grup riset mana yang asli menemukan unsur tersebut, dan penundaan penamaan unsur dalam waktu yang lama.
SEJARAH PERKEMBANGAN SISTEM PERIODIK UNSUR
Sistem periodik yang ada sekarang ini merupakan hasil dari perkembangan pengelompokkan unsur yang dilakukan oleh para ahli sebelumnya.
Pengelompokan Unsur Menurut Para Ahli
Awal Mula Perkembangan Pengelompokkan Unsur
- Ahli Kimia dari Arab dan Persia
Para ahli kimia dari Arab dan Persia awalnya mengelompokkan zat-zat berdasarkan sifat logam dan non logam.
- A. Antoine Lavoisier (1789)
Pada 1789, Lavoisier mengelompokkan 33 unsur kimia.
- GAS
Cahaya,Kalor,Oksigen,Nitrogen,Hidrogen
- TANAH
Kapur,Magnesium Oksida, Barium Oksida, Aluminium Oksida, Silikon Oksida
- LOGAM
Antimon, Perak, Arsenik, Bismuth, Kobalt, Tembaga, Timah, Besi, Mangan, Raksa, Molibdenum, Nikel, Emas, Platina,Timbel,Tungsten, Seng
- NON LOGAM
Sulfur, Fosfor, Karbon, Asam Klorida, Asam Fluorida, Asam Borak
Baca Juga Artikel Yang Mungkin Berhubungan : Larutan Basa : Pengertian, Ciri, Dan Sifat Beserta Contohnya Secara Lengkap
Kelemahan dan Kelebihan Teori Lavoisier
- Kelemahan : pengelompokan masih terlalu umum, ada senyawa dan zat lain yang bukan merupakan unsur.
- Kelebihan : sudah mengelompokkan 33 unsur yang ada berdasarkan sifat kimia sehingga bisa dijadikan referensi bagi ilmuwan-ilmuwan setelahnya.
- B. John Dalton (1808)
Dalton mengemukakan bahwa unsur dari atom yang berbeda mempunyai sifat dan massa yang berbeda. Massa atom diperoleh dari perbandingan massa atom unsur terhadap massa atom unsur hidrogen. Berangkat dari teorinya itu Dalton mengelompokkan zat-zat yang berupa unsur-unsur (sebanyak 36 unsur) berdasarkan kenaikan massa atomnya.
Daftar Unsur yang disusun oleh Dalton:

- C. John Jacobs Berzellius (1828)
Dalam daftar massa unsur yang dibuat oleh Dalton terdapat kesalahan dalam penentuan massa atom unsur. Pada tahun 1828 Barzellius berhasil membuat dan mempublikasikan daftar massa atom unsur-unsur yang lebih akurat.
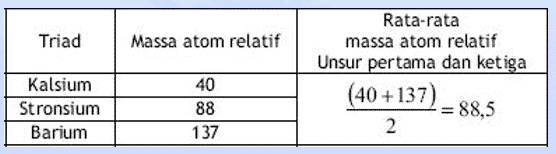
- D. Johann Dobereiner (1829)
*Ilmuwan pertama yang mengembangkan sistem periodik unsur (tahun 1817)
Pada tahun 1829, Johann Wolfgang Dobereiner, seorang ilmuwan Jerman, adalah yang pertama untuk mengklasifikasikan unsur-unsur ke dalam kelompok berdasarkan pernyataan John Dalton yaitu berdasarkan massa atomnya.
Dari hasil penelitiannya, diperoleh bahwa massa atom Stronsium hampir = massa atom rata-rata dua unsur lain yg mirip dengan Stronsium yaitu Kalsium dan Barium.
- Dobereiner membuat kelompok-kelompok unsur yang masing-masing kelompok terdiri atas tiga unsur yang disebut triade.
- Dalam satu triade, massa atom unsur yang terletak di tengah merupakan harga rata-rata massa atom pertama dan ketiga.
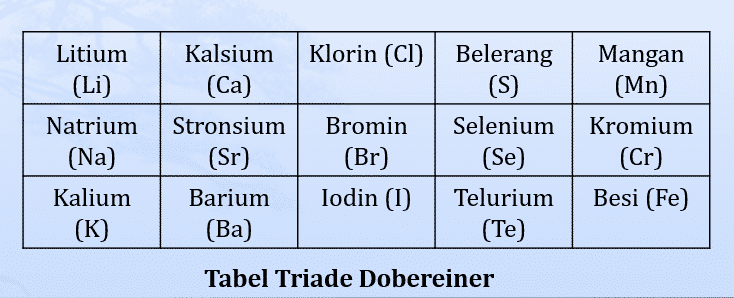
Kelemahan dan Kelebihan Triade Dobereiner
Kelemahan :
- Pengelompokan unsur ini kurang efisien dengan adanya beberapa unsur lain dan tidak termasuk dalam kelompok triade padahal sifatnya sama dengan unsur dalam kelompok triade tersebut.
- Sejumlah besar elemen yang sama tidak dapat dikelompokkan ke dalam triade misalnya, besi, mangan, nikel, kobalt, seng dan tembaga adalah elemen yang serupa tapi tidak bisa ditempatkan di triade.
- Memungkinkan unsur-unsur cukup berbeda dapat dikelompokkan ke dalam triade.
Kelebihan : adanya keteraturan setiap unsur yang sifatnya mirip; massa atom unsur yang kedua (tengah) merupakan massa atom rata-rata di massa atom unsur pertama dan ketiga.
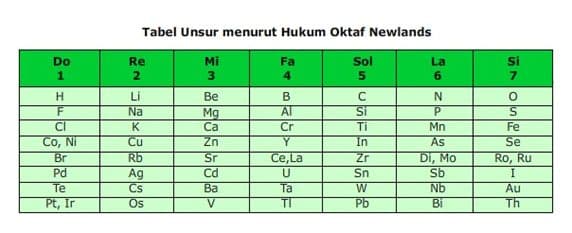
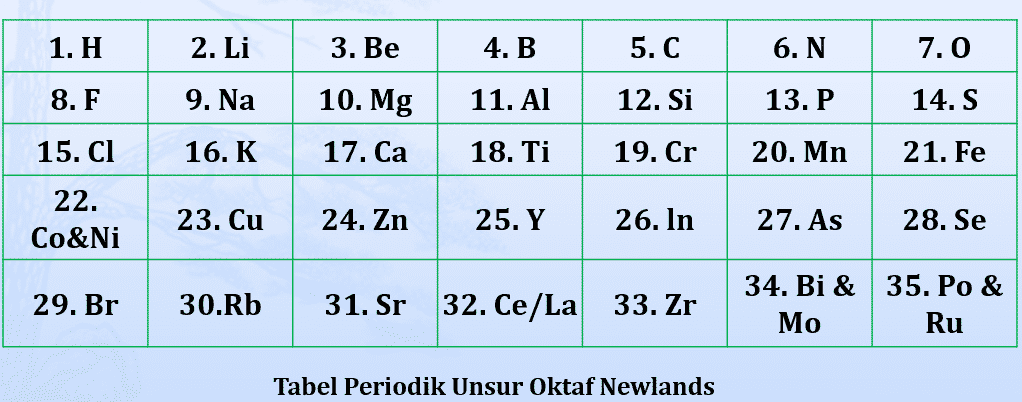
- E. John Alexander Reina Newlands (1865)
Pada tahun 1865, mengelompokkan unsur-unsur berdasarkan kenaikan massa atom. Ia mengamati setiap pengulangan delapan unsur akan terdapat kemiripan sifat. Dengan demikian berarti unsur kesatu mirip unsur kedelapan, unsur kedua mirip unsur kesembilan demikian seterusnya. Newlands menyebut pengulangan ini sebagai hukum oktaf.
Disebut hukum Oktaf karena beliau mendapati bahwa sifat-sifat yang sama berulang pada setiap unsur ke delapan dalam susunan selanjutnya dan pola ini menyerupai oktaf dalam tangga nada musik.
- Newlands menyatakan bahwa sifat-sifat unsur berubah secara teratur. Unsur pertama mirip dengan unsur kedelapan, unsur kedua mirip dengan unsur kesembilan, dan seterusnya.
Kelemahan dan Kelebihan Hukum Oktaf Newlands
Kelemahan dari teori ini adalah :
- Dalam kenyataannya masih ditemukan beberapa oktaf yang isinya lebih dari delapan unsur.
- Penggolongannya tidak cocok untuk unsur yang massa atomnya sangat besar.
- Hukum Oktaf Newlands ternyata hanya berlaku untuk unsur-unsur ringan.
- Jika diteruskan, teryata kemiripan sifat terlalu dipaksakan.
Kelebihan dari teori ini adalah unsur yang disusun ke dalam tabel periodik semakin banyak (kurang lebih sekitar 63 jenis unsur).
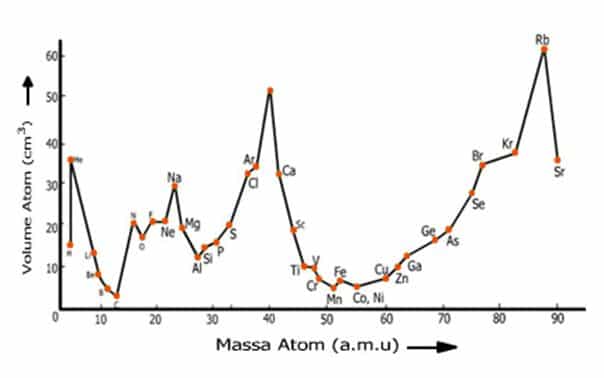
- f.Lothar Meyer (1869)
Pada tahun 1969, Lothar Meyer mengamati hubungan antara kenaikan massa atom dengan sifat unsur. Hal ini dilakukan antara lain dengan membuat Kurva volume atom versus fungsi massa atom.
Dari kurva, ia mengamati adanya keteraturan dari unsur-unsur dengan sifat yang mirip, dan pengulangan sifat unsur tidak selalu setelah 8 unsur, seperti dinyatakan dalam hukum oktaf.
Gambar Sistem periodik Meyer. Unsur-unsur disusun berdasarkan kenaikan massa atom secara vertikal. Pengulangan sifat unsur membentuk kolom. Sedangkan unsur-unsur dengan sifat yang mirip terletak pada baris yang sama.
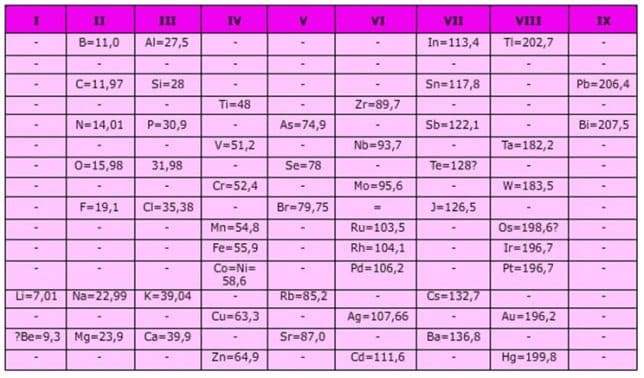
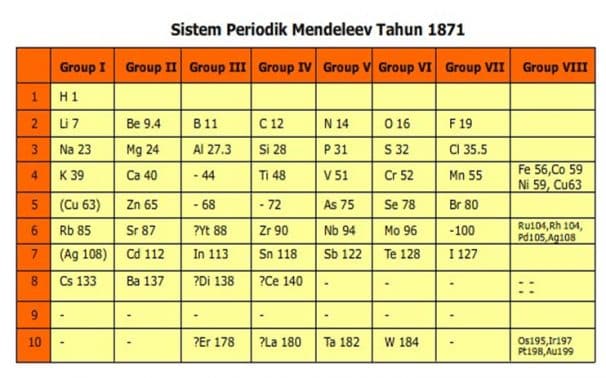
- G. Dmitri Ivanovich Mendeleev (1869)
Pada tahun 1869 Mendeleev membuat sistem periodik berdasarkan kenaikan massa atom dan kemiripan sifat. Unsur-unsur dengan sifat yang mirip ditempatkan pada kolom yang disebut golongan. Sedangkan pengulangan sifat menghasilkan baris yang disebut periode.
- Sistem periodik Mendeleev selain disusun berdasarkan kenaikan massa atom, juga ditentukan berdasarkan kemiripan.
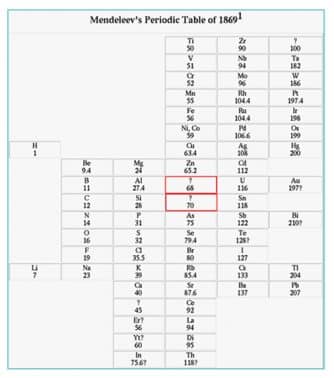
Keunggulan Sistem Periodik Mendeleev :
- Sistem Periodik Mendeleev menyediakan beberapa tempat kosong untuk unsur- unsur yang belum ditemukan. Sifat unsur-unsur tersebut dapat diramalkan berdasarkan kemiripan sifat unsur- unsur dalam golongan yang sama.
- Sistem Periodik Mendeleev meramalkan sifat-sifat unsur yang belum diketahui. Pada perkembangan selanjutnya, beberapa unsur yang ditemukan ternyata cocok dengan prediksi Mendeleev.
Contoh prediksi unsur Germanium oleh Mendeleev:
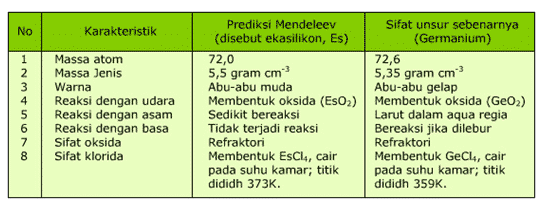
- Sistem Periodik Mendeleev menyediakan satu kolom yang kosong pada group VIII. Kolom ini yang pada perkembangannya berisi unsur-unsur gas mulia. Unsur-unsur ini sangat tidak reaktif, dalam bentuk gas yang tidak berwarna dan tidak berbau dan dalam jumlah yang sangat sedikit di atmosfir. Karena unsur ini tidak dikenal senyawanya,maka para ilmuan di masa Mendeleev tidak tahu adanya unsur ini.Lihat Sistem Periodik Mendeleev

Kelemahan Sistem Periodik Mendeleev :
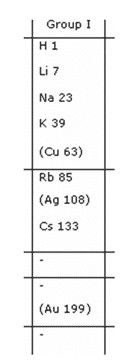
- Adanya unsur-unsur yang tidak mempunyai kesamaan sifat dimasukkan dalam satu golongan, misalnya Cu dan Ag ditempatkan dengan unsur Li, Na, K, Rb dan Cs.
- Adanya penempatan unsur-unsur yang tidak sesuai dengan kenaikan massa atom. Sebagai contoh, unsur Iodin (I-127) mempunyai massa atom yang lebih kecil dibandingkan unsur Telurium (Te-128). Namun dari sifatnya, Mendeleev terpaksa harus mendahulukan unsur Telurium dulu baru unsur Iodin.
- Kelemahan ini menyadarkan para ilmuan bahwa massa atom tidak menentukan sekali dimana suatu unsur empatkan dalam sistem periodik. Kemudian muncullah Sistem periodik Modern yang disusun berdasarkan kenaikan nomor atom. Nomor atom unsur Te (Z=52) yang ternyata lebih kecil dari iodin yaitu (Z=53).
- H. Henry Moseley (1913)
Setelah Rutherford menemukan muatan positif dalam inti atom, pada tahun 1913 ilmuan Henry Moseley menemukan nomor atom suatu unsur dengan bantuan sinar X. dari hasil penelitiannya tersebut ia menemukan bahwa kenaikan nomor atom sejalan dengan kenaikan massa atom. Atas dasar penemuan tersebut Henry Moseley menyusun tabel Periodik Berdasarkan kenaikan nomor atom.
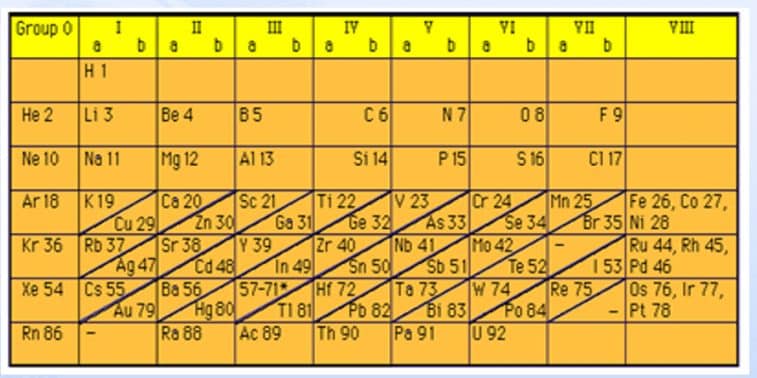
- Sistem Periodik Modern Moesley berhasil menemukan Sistem Periodik Unsur Modern yang disusun berdasarkan pada kenaikan nomor atom dan kemiripan sifatnya.
Sistem Periodik Modern
- Dari penemuan Moseley, hukum periodik Mendeleev diperbarui menjadi hukum periodik modern dengan sifat-sifat unsur merupakan fungsi periodik dari nomor atomnya.
- Dari penemuan Moseley, maka dibuat sistem periodik yang dikenal hingga saat ini yaitu sistem periodik modern.
- Lajur vertikal (golongan), disusun berdasarkan kemiripan sifat.
- Lajur horisontal (periode), disusun berdasarkan kenaikan nomor atom .
- Sistem periodik modern tersusun atas 7 periode dan 18 golongan yang terbagi menjadi 8 golongan utama (golongan A) dan 8 golongan transisi (golongan B).
Baca Juga Artikel Yang Mungkin Berhubungan : Hukum Newton 1, 2, 3 : Pengertian, Bunyi, Rumus dan Contoh Soal
Sistem periodik bentuk panjang (Sistem Periodik Modern) terdiri atas :
- 1. Golongan
Kolom-kolom vertikal dalam sistem periodik disebut golongan. Penempatan unsur-unsur pada golongan menunjukkan kemiripan sifat, jadi unsur segolongan akan memiliki kemiripan sifat satu dengan yang lainnya (terutama berlaku untuk golongan utama).
Ada dua cara penamaan golongan, yaitu :
- Sistem 8 Golongan
Menurut cara ini, sistem periodik dibagi menjadi 8 golongan, yakni 8 golongan utama (Golongan A) dan 8 golongan transisi (Golongan B). Nomor golongan ditulis dengan angka romawi.
- Sistem 18 Golongan
Menurut cara ini, sistem periodik dibagi ke dalam 18 golongan, yaitu golongan 1-18, dimulai dari kolom paling kiri. Unsur-unsur transisi terletak pada golongan 3-12.
Golongan terdiri dari :
- Golongan Utama (golongan A)
- Golongan IA : Golongan Alkali
- Golongan IIA : Golongan Alkali Tanah
- Golongan IIIA : Golongan Aluminium
- Golongan IVA : Golongan Karbon
- Golongan VA : Golongan Nitrogen
- Golongan VIA : Golongan Kalkogen
- Golongan VIIA : Golongan Halogen
- Golongan VIIIA : Golongan Gas Mulia
- Golongan Transisi (golongan B)
Golongan transisi terdiri dari :
- Golongan Transisi (Golongan B), yaitu golongan IIIB, IV B, VB, VIB, VIIB, VIIIB, IB dan IIB
- Golongan Transisi Dalam, yang terdiri dari :
- Lantanida, yang beranggotakan 15 unsur (nomor atom 57-71). Ke 15 unsur ini mempunyai sifat yang mirip dengan Lantanium (La), sehingga disebut Lantanida.
Aktinida, yang beranggotakan 15 unsur (nomor atom 89-103).
-
2. Periode
Lajur-lajur horizontal dalam sistem periodik disebut Periode dan ditulis dengan angka Arab.
Tabel 6 : Jumlah Unsur pada Setiap Periode
| Periode | Jumlah Unsur | Nomor Atom |
| 1 | 2 | 1-2 |
| 2 | 8 | 3-10 |
| 3 | 8 | 11-18 |
| 4 | 18 | 19-36 |
| 5 | 18 | 37-54 |
| 6 | 32 | 55-86 |
| 7 | 32 | 87-118 |
Periode 1,2 dan 3 disebut periode pendek karena berisi relatif sedikit unsur, sedangkan periode 4 dan seterusnya disebut periode panjang.
-
HUBUNGAN KONFIGURASI ELEKTRON DENGAN SISTEM PERIODIK
Hubungan antara letak unsur dalam sistem periodik dengan konfigurasi elektronnya dapat disimpulkan sebagai berikut.
- Nomor periode sama dengan jumlah kulit
- Nomor golongan sama dengan elektron valensi
Berdasarkan hubungan tersebut, maka letak unsur dalam sistem periodik dapat ditentukan berdasarkan konfigurasi elektron.
-
Sifat Periodik Unsur
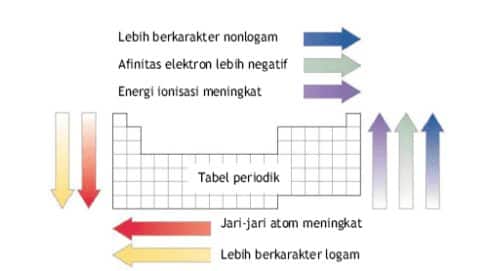
Sifat periodik adalah sifat yang berubah secara beraturan sesuai dengan kenaikan nomor atom, yaitu dari kiri ke kanan dalam satu periode, atau dari atas ke bawah dalam satu golongan.
-
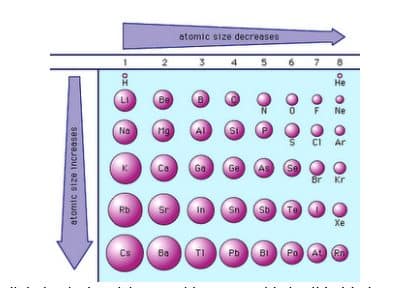
1. Jari-jari Atom
Jari-jari atom adalah jarak dari inti hingga kulit elektron terluar. Besar kecilnya jari-jari atom terutama ditentukan oleh dua faktor, yaitu jumlah kulit dan muatan inti.
- Untuk unsur-unsur segolongan, semakin banyak kulit atom, semakin besar jari-jarinya.
- Untuk unsur-unsur seperiode, semakin besar muatan inti, maka semakin kuat gaya tarik inti terhadap elektron, sehingga semakin kecil jari-jarinya
-
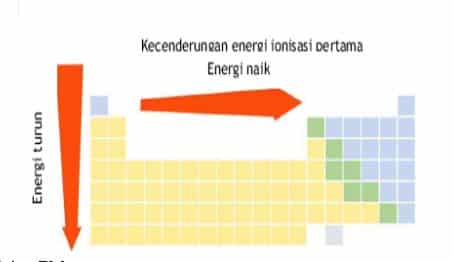
2. Energi Ionisasi
Energi Ionisasi adalah energi yang diperlukan untuk melepaskan elektron yang terikat paling lemah oleh suatu atom atau ion dalam wujud gas.
Hubungan energi ionisasi dengan nomor atom.
- dalam satu golongan, dari atas ke bawah, energi ionisasi semakin kecil
- dalam satu periode, dari kiri ke kanan, energi ionisasi cenderung bertambah
Besar kecilnya energi ionisasi bergantung pada besar gaya tarik inti terhadap elektron kulit terluar, yaitu elektron yang akan dilepaskan. Semakin kuat gaya tarik inti, semakin besar energi ionisasi
- dalam satu golongan, dari atas ke bawah, jari-jari atom bertambah besar, sehingga gaya tarik inti terhadap elektron terluar semakin lemah. Oleh karena itu, energi ionisasi berkurang
- dalam satu periode, dari kiri ke kanan, jari-jari atom berkurang, sehingga gaya tarik inti terhadap elektron semakin kuat. Oleh karena itu energi ionisasi bertambah
-
3. Afinitas Elektron
Afinitas elektron adalah besarnya energi yang dihasilkan atau dilepaskan apabila suatu atom menarik sebuah elektron
- Dalam satu golongan dari atas ke bawah, afinitas elektron cenderung berkurang
- Dalam satu periode dari kiri ke kanan, afinitas elektron cenderung bertambah
- Kecuali unsur alkali tanah dan gas mulia, semua unsur golongan utama mempunyai afinitas elektronn bertanda negatif. Afinitas elektron terbesar dimiliki oleh golongan halogen
-
4. Keelektronegatifan
Keelektronegatifan adalah kecenderungan suatu atom dalam menarik pasangan elektron yang digunakan bersama dalam membentuk ikatan. Unsur yang mempunyai energi ionisasi dan afinitas elektron yang besar tentu akan mempunyai keelektronegatifan yang besar pula.
-
5. Sifat Logam dan Nonlogam
Sifat-sifat unsur logam yang spesifik, antara lain : mengkilap, menghantarkan panas dan listrik, dapat ditempa menjadi lempengan tipis, serta dapat ditentangkan menjadi kawat/kabel panjang. Sifat-sifat logam tersebut diatas yang membedakan dengan unsur-unsur bukan logam. Sifat-sifat logam, dalam sistem periodik makin kebawah makin bertambah, dan makin ke kanan makin berkurang.
Batas unsur-unsur logam yang terletak di sebelah kiri dengan batas unsur-unsur bukan logam di sebelah kanan pada sistem periodik sering digambarkan dengan tangga diagonal bergaris tebal. Unsur-unsur yang berada pada batas antara logam dengan bukan logam menunjukkan sifat ganda.
Contoh :
- Berilium dan Aluminium adalah logam yang memiliki beberapa sifat bukan logam. Hal ini disebut unsur-unsur amfoter.
- Baron dan Silikon adalah unsur bukan logam yang memiliki beberapa sifat logam. Hal
ini disebut unsur-unsur metalloid.
-
6. Kereaktifan
Kereaktifan suatu unsur begantung pada kecenderungannya melepas atau menarik elektron. Dari kiri ke kanan dalam satu periode, mula-mula kereaktifan menurun kemudian bertambah hingga golongan VIIA
-
7. Jari-jari Ion
Ion mempunyai jari-jari yang berbeda secara nyata (signifikan) jika dibandingkan dengan jari-jari atom netralnya. Ion bermuatan positif (kation) mempunyai jari-jari yang lebih kecil, sedangkan ion bermuatan negatif (anion) mempunyai jari-jari yang lebih besar jika dibandingkan dengan jari-jari atom netralnya.
-
8. Titik Didih dan Titik Cair (Leleh)
Dalam satu periode, titik cair dan titik didih naik dari kiri ke kanan sampai golongan IVA, kemudian turun drastis. Titik cair dan titik didih terendah dimiliki oleh unsur golongan VIIIA.
Dalam satu golongan, ternyata ada dua jenis kecenderungan:
- Unsur-unsur golongan IA – IVA, titik cair dan titik didih makin rendah dari atas ke bawah
- Unsur-unsur golongan VA – VIIIA, titik cair dan titik didihnya makin tinggi.
- KETERKAITAN SISTEM PERIODIK DENGAN ATURAN AUFBAU; Blok s, p, d, dan f
Kaitan antara sistem periodik dengan konfigurasi elektron (asas Aufbau) dapat dilihat seperti pada gambar di bawah.
Dapat kita lihat bahwa asas Aufbau bergerak dari kiri ke kanan sepanjang periode, kemudian meningkat ke periode berikutnya. Setiap periode dimulai dengan subkulit ns dan ditutup dengan subkulit np (n = nomor periode).
| 1s | 2s, 2p | 3s, 3p | 4s, 3d, 4p | 5s, 4d, 5p | 6s, 4f, 5d, 6p | 7s, 5f, 6d | |
| Periode | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
Berdasarkan jenis orbital yang ditempati oleh elektron terakhir, unsur-unsur dalam sistem periodik dibagi atas blok s, blok p, blok d, dan blok f.
- Blok s: golongan IA dan IIA
Blok s tergolong logam aktif, kecuali H dan He. H tergolong nonlogam, sedangkan He tergolong gas mulia.
- Blok p: golongan IIIA sampai dengan VIIIA
Blok p disebut juga unsur-unsur representatif karena di situ terdapat semua jenis unsur logam, nonlogam, dan metaloid.
- Blok d: golongan IIIB sampai dengan IIB
Blok d disebut juga unsur transisi, semuanya tergolong logam.
- Blok f lantanida dan aktinida
Blok f disebut juga unsur transisi–dalam, semuanya tergolong logam. Semua unsur transisi–dalam periode 7, yaitu unsur-unsur aktinida, bersifat radioaktif
Hubungan Konfigurasi Elektron dengan Sistem periodik ?
Ada keterkaitan antara konfigurasi elektron dengan letak unsur dalam sistem periodik :
a. Letak periode unsur dapat diramalkan dari jumlah kulit elektron dari unsur tersebut
b. Letak golongan unsur dalam sistem periodik dapat diramalkan dari subkulit terakhir yang terisi elektron.
-
Manfaat SISTEM PERIODIK UNSUR
Sistem periodik dapat digunakan untuk memprediksi harga bilangan oksidasi, yaitu:
- Nomor golongan suatu unsur, baik unsur utama maupun unsur transisi, menyatakan bilangan oksidasi tertinggi yang dapat dicapai oleh unsur tersebut. Hal ini berlaku bagi unsur logam dan unsur non logam.
- Bilangan oksidasi terendah yang dapat dicapai oleh suatu unsur bukan logam adalah nomor golongan dikurangi delapan. Adapun bilangan oksidasi terendah bagi unsur logam adalah nol. Hal ini disebabkan karena unsur logam tidak mungkin mempunyai bilangan oksidasi negatif.
- SIMPULAN
- Sistem periodik unsur adalah suatu daftar unsur-unsur yang disusun dengan aturan tertentu. Semua unsur yang sudah dikenal ada dalam daftar tersebut.
- Sistem periodik modern disusun berdasarkan hukum periodik modern yang menyatakan bahwa sifat-sifat unsur merupakan fungsi periodik dari nomor atomya. Artinya, jika unsur-unsur disusun berdasarkan kenaikan nomor atomnya, maka sifat-sifat tertentu akan berulang secara periodik. Itu sebabnya tabel unsur-unsur tersebut dinamai Tabel Periodik atau Sistem Periodik.
- Lajur-lajur horizontal dalam sistem periodik disebut Sedangkan, kolom-kolom vertikal dalam sistem periodik disebut golongan
- Hubungan antara letak unsur dalam sistem periodik dengan konfigurasi elektronnya dapat disimpulkan sebagai berikut: Nomor periode sama dengan jumlah kulitdan Nomor golongan sama dengan elektron valensi
- Sifat periodik adalah sifat yang berubah secara beraturan sesuai dengan kenaikan nomor atom, yaitu dari kiri ke kanan dalam satu periode, atau dari atas ke bawah dalam satu golongan.
- Asas Aufbau bergerak dari kiri ke kanan sepanjang periode, kemudian meningkat ke periode berikutnya. Setiap periode dimulai dengan subkulit ns dan ditutup dengan subkulit np (n = nomor periode).
- SARAN
Demikianlah dari pembuatan makalah ini, apabila terdapat kekurangan, maka kiranya kritik dan saran dari pembaca sekalian, sehingga dalam pembuatan makalah selanjutnya dapat lebih baik, dan semoga makalah ini menambah pengetahuan pembaca sekalian. Amin.
Sponsor Iklan Text >>> https://www.technicaltalk.net/
Daftar Pustaka :
http://id.wikipedia.org/wiki/Unsur_kimia
http://www.duniaedukasi.net/2011/05/perkembangan-sistem-periodik-unsur.html
Sulami Emi. 2011. PR Kimia. Klaten: PT. Intan Pariwara.
Http://kinmlemoet.wordpress.com/2013/08/15/sistem-periodik-unsur-spu.html
Http://Chemistry08fun.wordpress.com
Http://Bisakimia.com