Hal ini unsur, stom dan isotop tentunya mempunyai pengertian yang berbeda, namun apabila ita melihat dari pengertian ketiganya itu memiliki keterkaitan.
Pengertian Unsur
Dalam hal ini merupakan zat tunggal yang secara kimia tidak dapat diuraikan lagi menjadi zat lain yang lebih sederhana.
Contohnya yakni Hidrogen dan Oksigen karena jenis gas tersebut tidak dapat diuraikan lagi menjadi zat yang lebih sederhana, lain halnya apabila ir dapat diuraikan oleh listrik menjadi dua jenis gas yaitu hidrogen dan oksigen.
Beberapa contoh unsure dalam kehidupan sehari-hari ialah besi, alumunium, timah, emas, tembaga, perak, oksigen, nitrogen, belerang dan karbon.
Baca Juga : Pengertian Unsur Kimia Beserta Sifat dan Fungsinya
Jenis-Jenis Unsur
Berikut ini adalah jenis-jenis dari unsur, sebagai berikut:
- Unsur Logam adalah unsur yang berwujud padat pada suhu kamar, dapat ditempa dan diregangkan, mengkilap jika digosok dan dapat menjadi penghantar listrik (konduktor) dan penghantar panas. Contoh unsur logam:
|
|
- Unsur Non Logam adalah unsur yang berwujud padat, cair atau gas pada suhu kamar, rapuh dan tidak dapat ditempa, tidak mengkilap walau digosok (kecuali intan) tidak bisa menjadi penghantar/Non-konduktor (kecuali grafit). Contoh unsur bukan logam (non logam):
|
|
Baca Juga : Tabel Periodik Unsur Kimia
Tata Nama Unsur
Penamaan unsur telah jauh sebelum adanya teori atom suatu zat, meski pada waktu itu belum diketahui mana yang merupakan unsur, dan mana yang merupakan senyawa. Ketika teori atom berkembang, nama-nama unsur yang telah digunakan pada masa lampau tetap dipakai. Misalnya, unsur “cuprum” dalam Bahasa Inggris dikenal dengan copper, dan dalam Bahasa Indonesia dikenal dengan istilahtembaga. Contoh lain, dalam Bahasa Jerman “Wasserstoff” berarti “hidrogen”, dan “Sauerstoff” berarti “oksigen”.
Nama resmi dari unsur kimia ditentukan oleh organisasi IUPAC. Menurut IUPAC, nama unsur tidak diawali dengan huruf kapital, kecuali berada di awal kalimat. Dalam paruh akhir abad ke-20, banyak laboratorium mampu menciptakan unsur baru yang memiliki tingkat peluruhan cukup tinggi untuk dijual atau disimpan. Nama-nama unsur baru ini ditetapkan pula oleh IUPAC, dan umumnya mengadopsi nama yang dipilih oleh penemu unsur tersebut.
Sifat-Sifat Unsur Kimia
Sifat-sifat dalam unsur kimia dibagi kedalam sifat fisika dan sifat kimia. Sifat fisika meliputi wujud, warna, kekerasan, kelarutan,, konduktivitas listrik dan panas, massa jenis, sifat magnet, jari-jari atom, kalor penguapan, titik didih dan titik leleh. Sedangkan sifat kimia meliputi kereaktifan unsur
-
Unsur-unsur golongan logam golongan alkali dan alkali tanah
Unsur-unsur dalam golongan alkali dan alkali tanah meliputi unsur-unsur golonggan IA ( 3Li 11Na 19K 37Rb 55Cs 87Fr ) dan IIA ( 4Be 12Mg 20Ca 38Sr 56Ba 88Ra ). Berikut tabel mengenai sifat-sifat unsur logam tersebut:
Sifat Fisika Unsur-Unsur Logam Alkali Tanah
| Sifat | Li | Na | K | Rb | Cs |
| nomor atom | 3 | 11 | 19 | 37 | 55 |
| Jari-jari atom (pm) | 155 | 190 | 235 | 248 | 267 |
| Jari-jari ion M+(pm) | 60 | 95 | 133 | 148 | 169 |
| Titik leleh (0C) | 181 | 97,8 | 63,6 | 38,9 | 28,4 |
| Titik didih (0C) | 1.347 | 883 | 774 | 688 | 678 |
| Kerapatan (g/cm3) | 0,53 | 0,97 | 0,86 | 1,59 | 1,90 |
| Kekerasan (skala Mohs) | 0,6 | 0,4 | 0,5 | 0,3 | 0,3 |
| Warna nyala | Merah | Kuning | Ungu | Merah | biru |
Sifat Kimia Unsur-Unsur Alkali
| Sifat | Li | Na | K | Rb | Cs |
| nomor atom | 4 | 12 | 20 | 38 | 56 |
| Jari-jari atom (pm) | 90 | 130 | 174 | 192 | 198 |
| Jari-jari ion M+(pm) | 3 | 65 | 99 | 113 | 135 |
| Titik leleh (0C) | 1.278 | 649 | 839 | 769 | 725 |
| Titik didih (0C) | 2.970 | 1.090 | 1.484 | 1.384 | 1.640 |
| Kerapatan (g/cm3) | 1,86 | 1,72 | 1,55 | 2,54 | 3,59 |
| Kekerasan (skala Mohs) | 5 | 2,0 | 1,5 | 1,8 | 2 |
| Warna nyala | Putih | Putih | Merah | Merah tua | hijau |
Sifat Kimia Unsur-Unsur Alkali tanah
| Sifat | Li | Na | K | Rb | Cs |
| Konfigurasi electron | [He]2s1 | [Ne]3s1 | [Ar]4s1 | [Kr]5s2 | [Xe]6s1 |
| Energi ionisasi pertama (kj/mol) | 519 | 498 | 418 | 401 | 376 |
| Keelektronegatifan | 1,0 | 0,9 | 0,8 | 0,8 | 0,7 |
| Potensial elektrode standar (volt) | -3,045 | -2,714 | -2,925 | -2,925 | -2,923 |
Dari tabel-tabel di atas dapat disimpulkan sebagai berikut:
a) Golongan alkali (IA)
- Mempunyai satu elektron terluar (ns1)
- Mempunyai satu elektron terluar (ns1)
- Energi ionisasi rendah (mudah melepaskan elektron)
- Reduktor kuat (mudah mengalami oksidasi)
- Sangat reaktif (di alam tidak ada unsur bebasnya).
- Reaksinya dengan air berlangsung cepat.
- Titik leleh rendah (lunak), sebab ikatan logam lemah.
Baca Juga : Pengertian Kimia – Sejarah, Cabang, Konsep, Industri, Manfaat
- Jari-jari atom makin ke bawah makin besar:
- makin ke bawah kereaktifan bertambah.
- makin ke bawah basanya makin kuat.
- makin ke bawah titik leleh makin rendah.
- Logam-logam alkali diperoleh dari elektrolisis leburan garam halidanya.
- Senyawa-senyawa alkali berikatan ion, berwujud padat, dan memiliki titik leleh tinggi.
- Reaksi menyala dengan nyala Na berwarna kuning dan K ungu.
- Semua senyawa alkali larut baik dalam air.
b) Golongan alkali tanah (IIA)
- Mempunyai dua elektron terluar (ns2):
- energi ionisasi rendah, tetapi IA lebih rendah.
- reduktor kuat, meskipun tidak sekuat IA.
- sangat reaktif, tetapi IA lebih reaktif.
- reaksinya dengan air berlangsung lambat.
- titik leleh cukup tinggi (keras), sebab ikatan logam lebih kuat dari IA.
- Jari-jari atom makin ke bawah makin besar:makin ke bawah kereaktifan bertambah.
- makin ke bawah basanya makin kuat.
- makin ke bawah titik leleh makin rendah.
- Logam-logam alkali diperoleh dari elektrolisis leburan garam halidanya.
Senyawa-senyawa alkali berikatan ion, berwujud padat, dan memiliki titik leleh tinggi - Reaksi menyala dengan nyala Sr merah dan Br hijau
- Senyawa Cl–, S2-, dan NO3 dari IIA larut baik dalam air.
Senyawa C032- dari IIA tidak ada yang larut. Kelarutan senyawa 504 2- dari IIA makin ke bawah makin kecil (makin sukar larut). Kelarutan basa (OH-) dari IIA semakin ke bawah semakin besar (semakin mudah larut)
-
Unsur- Unsur Logam Golongan Transisi
Unsur transisi dapat didefinisikan sebagai unsur-unsur yang memiliki subkulit d atau subkulit f yang terisi sebagian. Unsur transisi tersebut terdiri dari Sc (Scandium), Ti (Titanium), V (Vanadium), Cr (Krom), Mn (Mangan), Fe (Besi), Co (Kobalt), Ni (Nikel), Cu (Tembaga) dan Zn (Seng). Semua unsur transisi mempunyai sifat logam, hal ini terjadi karena unsur transisi memiliki lebih banyak electrontiak berpasangan. berikut ini sifat-sifat umum dari unsur-unsur logam golongan transisi.
- Biloksnya pasti positif,
- Pada umumnya mempunyai harga biloks lebih dari 1, kecuali Sc (+3) dan Zn (+2)
- Pada umumnya, ionnya berwarna, kecuali Sc2+, Zn2+, dan Ti4+,
- Dapat membentuk ion kompleks sebagai atom pusat.
- Memiliki ikatan logam yang sangat kuat
- Bersifat katalis (mempercepat reaksi).
- Titik didih dan titik leleh unsur transisi meningkat dari 1.541oC (Skandium) sampai 1.890 oC (Vanadium), kemudian turun sampai 1.083 oC (Tembaga) dan 420 oC (Seng).
- Senyawa-senyawa unsur transisi mempunyai bilangan oksidasi lebih dari satu. Adanya bilangan oksidasi lebih dari satu ini disebabkan mudahnya melepaskan elektron valensi. Dengan demikian, energi ionisasi pertama, kedua dan seterusnya memiliki harga yang relatif lebih kecil dibanding unsur golongan utama.
- Kebanyakan dari unsur-unsur dan senyawa logam transisi bersifat paramagnetik (tertarik oleh medan magnet) dan bukan bersifat diamagnetik (tidak tertarik oleh medan magnet).
- Sebagian besar ion-ion logam transisi berwarna.
-
Unsur-Unsur Golongan Halogen
Halogen adalah kelompok unsur kimia yang berada pada golongan VIIA di tabel periodik. Kelompok ini dari: fluor (F), klor (Cl), brom (Br), yodium (I), astatin (At), dan unsur ununseptium (Uus) yang belum ditemukan. Halogen menandakan unsur-unsur yang menghasilkan garam jika bereaksi dengan logam. Istilah ini berasal dari istilah ilmiah bahasa Perancis dari abad ke-18 yang diadaptasi dari bahasa Yunani. Sifat unsure-unsur golongan ini dapat dilihat pada tabel dibawah ini:
| Sifat | Flour | Klor | Brom | Iodium | Astatin |
| Massa atom | 19 | 35,5 | 80 | 127 | 210 |
| Jari-jari atom (A) | 72 | 99 | 115 | 133 | 155 |
| Titik leleh (0C) | -220 | -101 | -7 | -113 | 302 |
| Titik didih (0C) | -188 | -35 | 59 | 183 | 337 |
| Keelektronegatipan | 4,1 | 2,8 | 2,8 | 2,5 | 2,2 |
| Wujud | gas | gas | cair | padat | Padat |
| Warna | Kuning muda | Hijau kekuningan | Merah coklat | ungu |
Berdasarkan tabel di atas dapat di ketahui sifat unsur-unsur golongn hologen sebagai berikut:
- Sangat reaktif (oksidator kuat), beracun.
- Oksidator : F2>Cl2>Br2>I2
- Reduktor : I->Br->Cl->F-
- Jari-jari atomnya dari bawah ke atas semakin kecil.
- Elektronegatifanya dari kiri kekanan semakin besar.
- Energi ionosasi dadari kiri ke kanan semakin besar.
- Afinitas electron dari bawah keatas semakin kecil
-
Unsur-Unsur Golongan Gas Mulia
Gas mulia adalah unsur-unsur golongan VIIIA (18) dalam tabel periodik. Disebut mulia karena unsur-unsur ini sangat stabil (sangat sukar bereaksi). Gas mulia dahulu disebut juga golongan nol. Gas mulia terdiri atas unsure-unsur helium (He), neon (Ne), argon (Ar), krypton (Kr), xenon (Xe) dan radon (Rn). Sifat umum golongan ini dapat dilihat dalam tabel di bawah ini.
| Sifat | Gas Mulia | |||||
| He | Ne | Ar | Kr | Xe | Rn | |
| Nomor atom | 2 | 10 | 18 | 36 | 54 | 86 |
| Massa atom | 4 | 20 | 40 | 84 | 131 | 222 |
| Jari-jari atom(A) | 0,93 | 1,12 | 1,54 | 1,69 | 1,90 | 2,20 |
| Energi ionisasi(kJmol-1) | 2.640 | 2.080 | 1.420 | 1.350 | 1.170 | 1.040 |
| Titik didih (0C) | -269 | -246 | -180 | -152 | -107 | -62 |
| Titik leleh (0C) | -272 | -249 | -189 | -157 | -112 | -71 |
Adapun secara umum sifat-sifat unsur- unsur golongan gas mulia sebagai berikut:
- Tidak Berwarna, tidak berbau, tidak berasa, sedikit larut dalam air.
- Mempunyai elektron valensi 8, dan khusus untuk Helium elektron valensinya 2, maka gas mulia bersifat kekal dan diberi valensi nol.
- Molekul-molekulnya terdiri atas satu atom (monoatom)
- Energi ionosasinya sangat tinggi, akibatnya unsure-unsur gas mulia suksar bereaksi dengan unsur lainnya.
- Pada tabel dapat dilihat bahwa titik leleh dan titik didihnya sangat rendah, namun baik titik leleh maupun titik didih semakin kebawah semakin tinggi, sesuai dengan semakin besarnya massa atom gas mulia.
-
Unsur Karbon
Karbon merupakan unsur yang terletak pada periode 2 golongan IVA dalam sistem periodik. Unsur karbon pada suhu kamar (298 ?K , 1 atm) berbentuk padatan yang berupa Kristal, terdiri atas banyak atom karbon yang berikatan kovalen. Sifat fisika karbon dapat diamati pada tabel berikut:
| Sifat | Keterangan |
| Titik leleh (C) | 3500 |
| Titik didih (C) | 3930 |
| Jari-jari kovalen | 0,77 |
| Jari-jari ion | 0,15 |
| Warna (arang) | Hitam |
Secara umum, sifat kimia karbon antara lain sebagai berikut.
- Sangat tidak reaktif, jika bereaksi, tidak ada kecenderungan atom-atom karbon kehilangan elektron-elektron terluar untuk membentuk ion C4+. Beberapa reaksi unsur karbon diantaranya sebagai berikut.
- Karbon ada yang membentuk senyawa organik dan ada juga yang membentuk senyawa anorganik. Senyawa organik di antaranya senyawa hidrokarbon, alkohol, aldehida, keton, ester,dan asam karboksilat, senyawa karbon anorganik di anataranya oksida, karbida, karbonat, sulfida, dan halida.
- Atom karbon mempunyai beberapa alotropi, yaitu bentuk struktur yang berbeda dari suatu atom yang sama, antara lain grafit, intan, fuleren, bulkyball, dan arang.
- Karbon dalam bentuk senyawa H2CO3 dapat terionisasi (larut) di dalam air.
- Mempunyai energy ionisasi sebesar 11,3 kJ/mol.
- Mempunyai nilai keelektrponegatifan sebesar 2,5.
-
Unsur Nitrogen
Terletak pada periode 3 golongan VA, berwujud gas pada suhu ruangan standar. Sifat fisika nitrogen
| Sifat | Keterangan |
| titik leleh (oC) | -210 |
| titik didih (oC) | -196 |
| jari-jari kovalen (A) | 0,75 |
| jari-jari ion (N3+) (A) | 1,71 |
| jari-jari ion (N5+) (A) | 0,11 |
| warna pada suhu kamar | gas tidak berwarna |
Baca Juga : Daur Nitrogen : Siklus, Proses, Bentuk dan Contoh
Sifat kimia unsur nitrogen:
- Kurang reaktif, terlihat dari banyaknya proses di alam yang tidak melibatkan nitrogen melainkan oksigen meskipun komposisi terbesar udara adalah nitrogen (78%). Berikut beberapa reaksi nitrogen.
- Dapat bertindak sebagai zat pengoksidasi (oksidator) dan zat pereduksi (reduktor). Nitrogen sebagai oksidator mempunyai biloks -1, -2, dan -3, sedangkan sebagai reduktor mempunyai biloks +1, +2, +3, +4, dan +5. Biloks nitrogen yang paling umum adalah -3, +3, dan +5.
- Mempunyai energi ionisasi sebesar 14,5 kJ/mol.
- Mempunyai nilai keelektronegatifan sebesar 3,0.
-
Unsur Oksigen
Terletak pada periode 3 golongan VIA. Berwuju gas pada suhu ruang: 298 K, 1 atm. Sifat fisika unsur oksigen.
| Sifat | Keterangan |
| titik leleh (oC) | -218,8 |
| titik didih (oC) | -183,0 |
| jari-jari kovalen (A) | 0,73 |
| jari-jari ion (O2-) (A) | 1,4 |
| warna pada suhu kamar | gas tidak berwarna |
Sifat-sifat kimia unsur oksigen:
- Mempunyai elektron terluar sebanyak 6 elektron dengan biloks -2.
- Mempunyai 2 alotrop, yaitu gas oksigen (O2) dan ozon (O3).
- Mengalami reaksi oksidasi dengan sebagian besar unsur membentuk senyawa oksida (contoh: Na2O), peroksida (contoh: Na2O2), superoksida (contoh: NaO2), dan senyawa-senyawa karbon.
- Mempunyai energi ionisasi sebesar 14,5 kJ/mol.
- Mempunyai nilai keelektronegatifan sebesar 3,0.
-
Unsur-unsur periode ketiga
Unsur-unsur yang menempati periode ketiga antara lain Na, Mg, Al, Si, P, S, Cl, dan Ar. Sifat-sifat umum unsur-unsur tersebut berurut dari Na sampai Ar adalah sebagai berikut:
- Jari-jari semakin kecil karena jumlah e- valensinya semakin banyak.
- Sifat logam semakin berkurang
- Sifat basa berkurang, sifat asam bertambah
- Sifat reduktor berkurang, oksidator bertambah
- Energi ionisasi bertambah
- Keelektronegatifan bertambah
- Kelogaman: Na, Mg, Al ( logam ), Si ( semilogam ), P, S, Cl, Ar ( bukan logam )
- Semakin bersifat oksidator
- Konduktor: Na, Mg, Al. Bersifat Isolator: Si, P, S, Cl, Ar
- Kekuatan basa: semakin bersifat asam
-
Sifat Unsur-Unsur Transisi Periode Keempat
Unsur-unsur transisi periode keempat mempunyai sifat-sifat yang khas. Sifat-sifat khas unsur periode keempat antara lain:
- Bersifat logam, maka sering disebut logam transisi.
- Bersifat logam, maka mempunyai bilangan oksidasi positif pada umumnya lebih dari satu.
- Banyak diantaranya dapat membentuk senyawa kompleks
- Pada umumnya senyawanya berwarna
- Beberapa diantaranya dapat digunakan sebagai katalisator
Bahaya Unsur-Unsur Kimia
Berikut ini bahaya unsur-unsur kimia, sebagai beirkut:
-
Karbon
- Dalam bentuk CO2 menyebabkan terjadinya efek rumah kaca
- Dalam bentuk CFC menyebabkan penipisan lapisan ozon
- Dalam bentuk CCL4 menyebabkan kerusakan hati dan ginjal
- Dalam bentuk CS2 bersifat racun
- Dalam bentuk CO menyebabkan darah kekurangan oksigen
-
Nitrogen
Campuran NO dan NO2 menyebabkan terjadinya hujan asam dan kabut yang mengakibatkan iritasi pada mata dan tumbuhan menjadi kering. Selain itu hujan asam dapat merusak pH, perairan , dan bangunan.
-
Silikon
Silikon yang digunakan untuk kecantikan wajah dapat menyebabkan kerusakan bentuk wajah dan melumpuhkan beberapa otot wajah.
-
Fosfor
Jika biji fosfor diolah menjadi fosfat dan larutan dalam air akan menyebabkan terjadinya limbah radioaktif.
-
Belerang
Belerang dalam bentuk H2Ssangat beracun dan dapat menyebabkan kematian, sedangkan dalam bentuk H2SO4 dapat merusak kulit dan menyebabkan korosi.
-
Radon
Jika radon terhirup, akan ter tinggal di paru-paru dan dapat menyebabkan kanker paru- paru.
-
Aluminium
Aluminium dapat merusak kulit, dalam bentuk bubuk dapat meledak di udara jika dipanaskan , dan dalam bentuk AL2O3 jika di reaksikan dengan karbon akan menyebabkan pemanasan global.
-
Krom
Krom sangat beracun dan dapat menyebabkan kanker.
-
Mangan
Pada pengelasan baja dengan logam Mn akan dihasilkan asap, yang bersifat racun dan dapat mengganggu system saraf pusat.
-
Logam Tembaga
Pada penambangan tembaga terdapat pasir sisa yang masih mengandung logam CO. Jika pasir sisa ini dibuang ke perairan, maka akan membahayakan bagi organisme-organisme perairan.
Pengertian Atom
Dalam hal ini merupakan sebuah bagian terkecil dari suatu unsur yang masih mempunyai suatu sifat unsur tersebut.
- Setiap atom dari suatu unsur memiliki sifat tertentu yang berbeda dengan sifat atom unsur yang lain. Yang perbedaan ini meliputi sifat kimia dan sifat fisiknya.
- Perbedaan antratom terjadi karena perbedaan jumlah proton, elektron dan neutron penyusunnya.
Baca Juga : Pengertian dan Teori Atom
PERKEMBANGAN MODEL ATOM
Istilah atom bermula dari zaman Leukipos dan Demokritus yang mengatakan bahwa benda yang paling kecil adalah atom. Atom yang berasal dari bahasa Yunani yaitu atomos, a artinya tidak dan tomos artinya dibagi. Model atom mengalami perkembangan seiring dengan perkembangan ilmu pengetahuan dan berdasarkan fakta-fakta eksperimen. Walaupun model atom telah mengalami modifikasi, namun gagasan utama dari model atom tersebut tetap diterima sampai sekarang. Perkembangan model atom dari model atom Dalton sampai model atom mekanika kuantum yaitu sebagai berikut:
-
Model atom Dalton
Pada tahum 1803, John Dalton mengemukakan teorinya sebagai berikut:
- setiap unsur tersusun atas partikel-partikel kecil yang tidak dapat dibagi lagi yang disebut atom.
- atom-atom dari unsur yang sama akan mempunyai sifat yang sama, tetapi atom-atom dari unsur berbeda mempunyai sifat yang berbeda pula.
- dalam reaksi kimia tidak ada atom yang hilang, tetapi hanya terjadi perubahan susunan atom-atom dalam unsur tersebut.
- bila atom membentuk molekul, atom-atom tersebut bergabung dengan angka perbandingan yang bulat dansederhana, seperti 1 : 1, 2 : 1 , 2 : 3.
Model atom Dalton mempunyai beberapa kelemahan. Beberapa kelemahan itu diantaranya
- Tidak dapat menjelaskan sifat listrik materi
- Tidak dapat menjelaskan gaya gabung unsur-unsur. Misalnya, mengapa dalam pembentukan air (H2O) satu atom oksigen mengikat dua atom hydrogen.
-
Model atom Thomson
Setelah J.J. Thomson menemukan bahwa di dalam atom terdapat elektron, maka Thomson membuat model atom sebagai berikut:
- Atom merupakan suatu materi berbentuk bola pejal bermuatan positif dan di dalamnya tersebar elektron-elektron (model roti kismis).
- Atom bersifat netral, jumlah muatan positif sama dengan jumlah muatan negatif.
- Model atom Thomson tidak bertahan lama. Hal ini disebabkan karena model atom Thomson tidak menjelaskan adanya inti atom.
Baca Juga : Partikel Penyusun Atom – Pengertian, Sejarah, Elektron, Proton, Neutron, Inti Atom, Para Ahli
-
Model atom Rutherford
Setelah Rutherford menemukan inti atom yang bermuatan positif dan massa atomnya terpusat pada inti, maka Rutherford membuat model atom sebagai berikut:
- atom terdiri atas inti atom yang bermuatan positif dan elektron yang bermuatan negatif mengelilingi inti atom;
- atom bersifat netral;
- jari-jari inti atom dan jari-jari atom sudah dapat ditentukan.
-
Model Atom Rutherford
Dengan berkembangnya ilmu pengetahuan alam, ternyata model Rutherford juga memiliki kekurangan. Kelemahan mendasar dari model atom Rutherford ialah tidak dapat menjelaskan mengapa elektron yang beredar mengelilingi inti tidak jatuh ke inti karena ada gaya tarik menarik antara inti dan elektron. Dan menurut ahli fisika klasik pada massa itu (teori Maxwell), elektron yang bergerak mengelilingi inti atom akan melepaskan energi dalam bentuk radiasi.
-
Model atom Bohr
Berdasarkan hasil pengamatannya pada spektrum atom hidrogen, Neils Bohr memperbaiki model atom Rutherford, dengan menyusun model atom sebagai berikut:
- Atom terdiri atas inti atom yang mengandung proton bermuatan positif dan elektron bermuatan negatif yang mengelilingi inti atom; Ruang hampa Elektron mengelilingi inti Inti atom (bermuatan positif).
- Model atom mekanika kuantum
Model atom mekanika kuantum didasarkan pada:
- elektron bersifat gelombang dan partikel, oleh Louis de Broglie (1923);
- persamaan gelombang elektron dalam atom, oleh Erwin Schrodinger; (1926)
- asas ketidakpastian, oleh Werner Heisenberg (1927).
-
Model atom mekanika kuantum
Menurut teori atom mekanika kuantum, elektron tidak bergerak pada lintasan tertentu. Berdasarkan hal tersebut maka model atom mekanika kuantum adalah sebagai berikut:
- Atom terdiri atas inti atom yang mengandung proton dan neutron, dan elektron-elektron mengelilingi inti atom berada pada orbital-orbital tertentu yang membentukkulit atom, hal ini disebut dengan konsep orbital.
- Dengan memadukan asas ketidakpastian dari Werner Heisenberg dan mekanika gelombang dari Louis de Broglie, Erwin Schrodinger merumuskan konsep orbital sebagai suatu ruang tempat peluang elektron dapat ditemukan.
- Kedudukan elektron pada orbital-orbitalnya dinyatakan dengan bilangan kuantum.
Baca Juga : 4 Pengertian Struktur Atom Beserta Modelnya Dalam Sebauh Teori Ahli
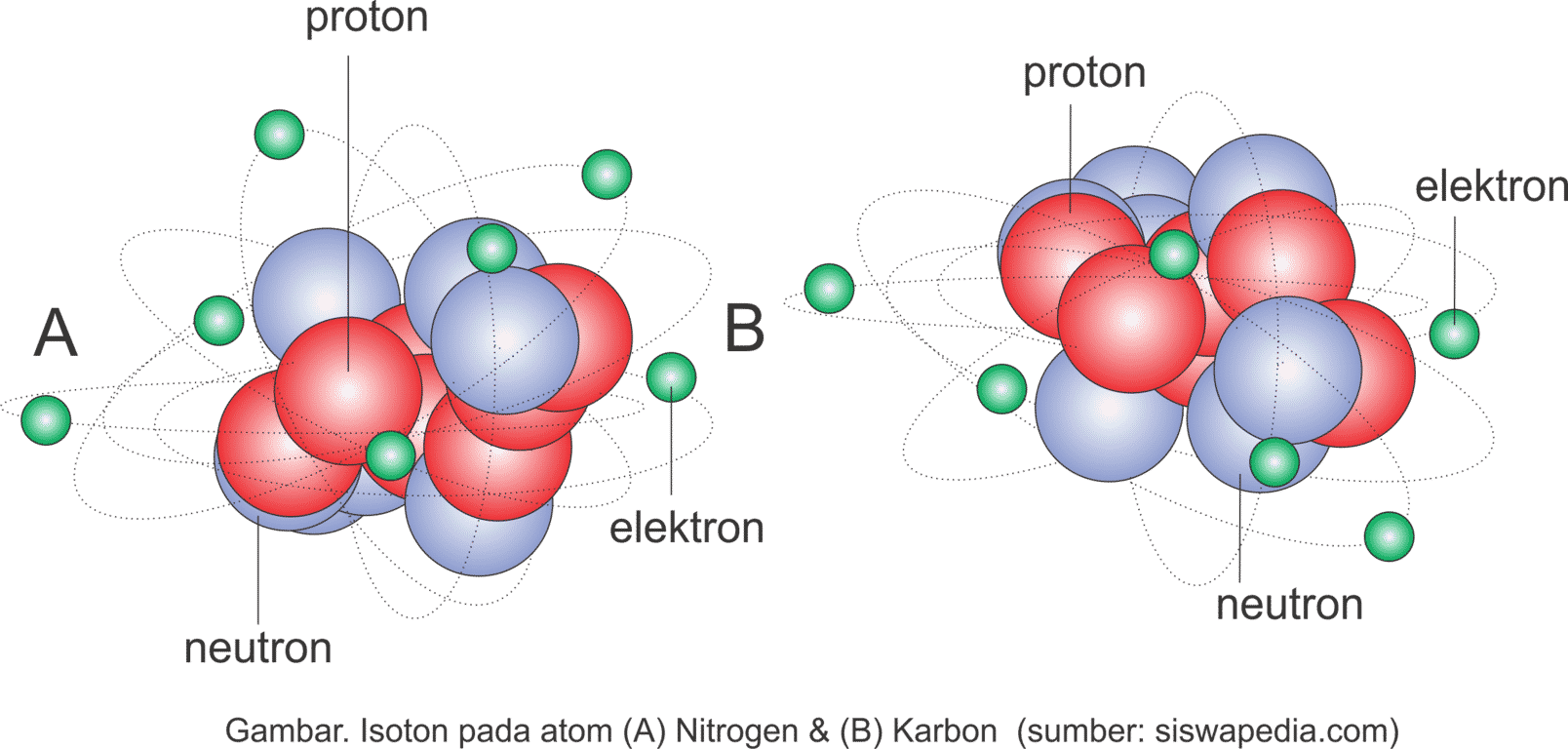
Pengertian Isotop
Isotop adalah nuklida-nuklida yang mempunyai nomor atom (jumlah proton) sama, tetapi mempunyai nomor massa (jumlah neutron) berbeda. Jadi, setiap unsur mungkin saja terdiri atas beberapa jenis nuklida yang sama. Isotop yang mempunyai inti stabil disebut isotop stabil. Isotop tidak stabil mempunyai inti tidak stabil yang merupakan nuklida radioaktif dan akan meluruh. Nuklida yang dikenal terdapat lebih dari 3 000 nuklida, sekitar 280 di antaranya adalah nuklida stabil dan lainnya adalah nuklida radioaktif. Beberapa contoh isotop stabil dan isotop tidak stabil adalah:
Unsur Isotop stabil Isotop tidak stabil
H H1, H2 H3
K K39, K41 K38, K40, K42, K44
Co Co59 Co57Co58, Co60, Co61
Pb Pb206, Pb208 Pb205, Pb207, Pb209
Daftar Pustaka:
- Friedlander G,. Kennedy J.W, Macias E.S, Miller J.M. 1981. Nuclear and Radiochemistry. New York : John Wiley & Sons
- Winarni. 2007. Kimia untuk SMA dan MA kelas XII IPA. Jakarta : Satubuku.
- Rahardjo, Sentot Budi. 2008. KIMIA 3 Berbasis Eksperimen. Solo: Platinum.