Air murni tidak mempunyai rasa, baud an warna. Bila mengandung zat tertentu, air dapat terasa asam, pahit, asin dan sebagainya. Air yang mengandung zat lain dapat pula menjadi berwarna. Kita ketahui bahwa cairan yang berasa asam di sebut karutan asam, yang terasa asin disebut larutan garam, sedangkan yang terasa licin dan pahit di sebut larutan basa. Di ingatkan, jangan mencicipi larutan untuk mengetahui rasanya, sebab berbahaya. Cara yang baik adalah mencelupkan kertas lakmus, karena lakmus dalam larutan asam berwarna merah, dan dalam basa berwarna putih.

Sifat asam dan basa larutan tidak hanya terdapat dalam larutan air, tetapi juga dalam larutan lain seperti amoniak, eter, dan benzene, akibatnya, cukup sulit mengetahui sifat asam dan basa larutan yang sesungguhnya.oleh sebab itu, asam dan basa dapat dijelaskan dengan teori yang disebut teori asam basa, yaitu yang di kemukakan oleh Arrhenius, Bronsted-lowry, dan Lewis.
Teori Asam
Asam (yang sering diwakili dengan rumus umum HA) secara umum merupakan senyawa kimia yang bila dilarutkan dalam air akan menghasilkan larutan dengan pH lebih kecil dari 7. Dalam definisi modern, asam adalah suatu zat yang dapat memberi proton (ion H+) kepada zat lain (yang disebut basa), atau dapat menerima pasangan elektron bebas dari suatu basa. Suatu asam bereaksi dengan suatu basa dalam reaksi penetralan untuk membentuk garam.
Contoh asam adalah asam asetat (ditemukan dalam cuka) dan asam sulfat (digunakan dalam baterai atau aki mobil). Asam umumnya berasa masam; walaupun demikian, mencicipi rasa asam, terutama asam pekat, dapat berbahaya dan tidak dianjurkan.
- Sifat-sifat asam
Secara umum, asam memiliki sifat sebagai berikut:
- Rasa : masam ketika dilarutkan dalam air.
- Sentuhan : asam terasa menyengat bila disentuh, terutama bila asamnya asam kuat.
- Kereaktifan : asam bereaksi hebat dengan kebanyakan logam, yaitu korosif terhadap logam.
- Hantaran listrik: asam, walaupun tidak selalu ionik, merupakan elektrolit.
- Penggunaan asam
Asam memiliki berbagai kegunaan. Asam sering digunakan untuk menghilangkan karat dari logam dalam proses yang disebut “pengawetasaman” (pickling). Asam dapat digunakan sebagai elektrolit di dalam baterai sel basah, seperti asam sulfat yang digunakan di dalam baterai mobil. Pada tubuh manusia dan berbagai hewan, asam klorida merupakan bagian dari asam lambung yang disekresikan di dalam lambung untuk membantu memecah protein dan polisakarida maupun mengubah proenzim pepsinogen yang inaktif menjadi enzim pepsin. Asam juga digunakan sebagai katalis; misalnya, asam sulfat sangat banyak digunakan dalam proses alkilasi pada pembuatan bensin.
- Asam lemah dan asam kuat
adalah asam yang tidak terionisasi secara signifikan dalam larutan. Misalnya jika sebuah asam dilambangkan dengan HA, maka dalam larutan masih terdapat sejumlah besar HA yang belum terdisosiasi/terionisasi. Dalam air, sebuah asam lemah terdisosiasi sebagai berikut :
Konsentrasi kesetimbangan dari reaktan dan produk dihubungkan melalui persamaan konstanta keasaman, Ka
Semakin besar nilai Ka, maka semakin banyak pembentukan H+, sehingga pH larutan semakin kecil. Nilai Ka asam lemah berkisar antara 1.8×10-16 dan 55.5. Asam dengan Ka dibawah 1.8×10-16, merupakan asam yang lebih lemah daripada air, sehingga bersifat basa.
Sedangkan asam dengan Ka diatas 55.5 adalah asam kuat yang hampir terdisosiasi dengan sempurna saat dilarutkan dalam air. Sebagian besar asam adalah asam lemah. Asam-asam organik adalah anggota terbesar dari asam lemah. Asam lemah terdapat di rumah tangga seperti asam asetat dalam cuka dan asam sitrat dalam jeruk.
Teori Basa
Definisi umum dari basa adalah senyawa kimia yang menyerap ion hydronium ketika dilarutkan dalam air.Basa adalah lawan (dual) dari asam, yaitu ditujukan untuk unsur/senyawa kimia yang memiliki pH lebih dari 7. Kostik merupakan istilah yang digunakan untuk basa kuat. jadi kita menggunakan nama kostik soda untuk natrium hidroksida (NaOH) dan kostik postas untuk kalium hidroksida (KOH). Basa dapat dibagi menjadi basa kuat dan basa lemah. Kekuatan basa sangat tergantung pada kemampuan basa tersebut melepaskan ion OH dalam larutan dan konsentrasi larutan basa tersebut.
6 DEFINISI Pengertian Dasar Teori ASAM-BASA Menurut Para Ahli :
Asam ialah senyawa yang dalam larutannya dapat menghasilkan ion H+.
Basa ialah senyawa yang dalam larutannya dapat menghasilkan ion OH-.
Secara kimia dapat di nyatakan :
1) HCl(aq) H+(aq) + Cl- (aq) (asam)
2) HA + aq H + (aq) + A – (aq ) (asam)
3) NaOH(aq) Na+(aq) + OH-(aq) (basa)
4) BOH + aq B+ (aq) + OH- (aq) (basa)
Setelah diteliti ternyata H + (proton) tidak mungkin berdiri bebas dalam air, tetapi berikatan koorfinasi dengan oksigen air, membentuk ion hodronium (H3O+)
H+ + H2O ——–> H3O+
Ion H3O+ dan OH- terdapat dalam air murni melalui reaksi
H2O + H2O ——–> H3O+ + OH-
|
Contohnya :
NaOH ——–> Na + OH-
Ba(OH)2 ——–> Ba + 2OH-
NH4OH ——–> NH4 + OH-
Menurut teori asam basa Brønsted-Lowry, sifat asam atau basa ditentikan oleh kemampuan senyawa melepas atau menerima proton (H + )
Asam adalah senyawa atau partikel tang dapat memberikan proton (H +) kepada senyawa atau partikel lain. Basa adalah senyawa atau partikel yang dapat menerima proton (H +) dari asam.
Asam
Zat dalam larutan disebut asam (HA) bila dapat melepaskan proton kepada molekul pelarut (HL).
HA + HL H2L+ + A –
Sebagai contoh :
HCL(g) + H2O H3O (aq) + CL (aq)
Jadi, ternyata air bersifat basa bila terdapat asam didalamnya.
Basa
Yang disebut basa (B) hádala zat yang dapat menerima proton dari pelarut (HL).
B + HL H + + L –
Reaksi umum basa (B) dalam pelarut air ádalah :
B + H2O H + + O
Pada contoh di atas terlihat bahwa air dapat bersifat sebagai asam (proton donor) dan sebagai basa (proton akseptor). Zat atau ion atau spesi seperti ini bersifat ampiprotik (amfoter).
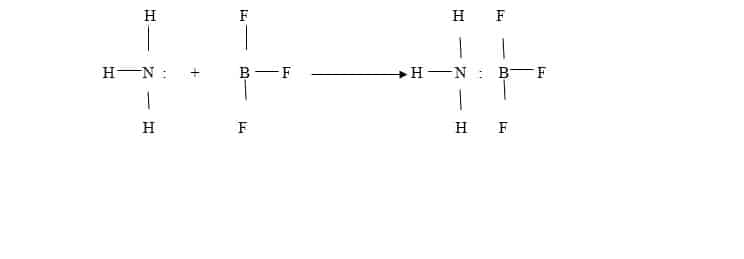
Walaupun teori Bronsted-Lowry lebih umumdari teori Arrhenius, ada reaksi yang nirip asam-basa tetapi tidak dapat di jelaskan dengan teori ini, contohnya antara NH3 dengan BF3 menjadi H3N-BF3
Disini terjadi ikatan koordinasi antara atom N dengan B yang pasangan elektronnya berasal dari N. Berdasarkan pembentukan ikatan koordinasi, Bilbert N. Lewis menyatakan teori yang disebut teori asam-basa Lewis.
Asam adalah suatu partikel yang dapat menerima pasangan elektron dari partikel lain untuk membentuk ikatan kovalen koordinasi. Basa adalah suatu partikel yang dapat memberikan pasangan elektron kepada partikel lain untuk membentuk ikatan kovalen koordinasi.
-
Teori Asam-Basa HSAB
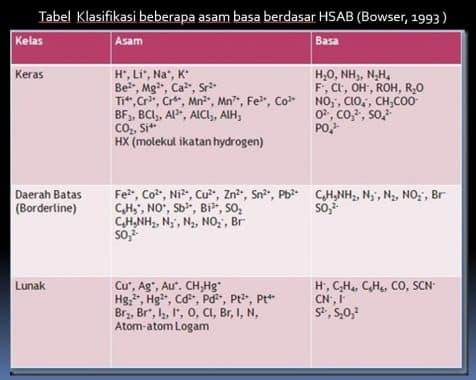
- R.G Pearson awal tahun 1960 mengusulkan bahwa asam basa lewis dapat diklasifikasikan sebagai asam basa lunak (soft) atau keras (hard).
- Asam Keras suka dengan Basa Keras, Asam Lunak suka dengan Basa Lunak
Asam basa Keras, syaratnya :
1.Jari-jari atom kecil
2.Bilangan oksidasinya tinggi
3.polaritasnya rendah
4.elektronegatifitasnya tinggi
Contoh Asam Keras : H+, Na+, Li+, K+, Ti4+, Cr3+, Cr6+,BF3, R3C+ dll
Contoh Basa Keras : OH-, OR-, F-,Cl-, NH3, CH3COO-, N2H4, CO3 2-, dsb.
Klasifikasi HSAB
Peran klasifikasi : untuk meramalkan reaksi berbagai macam spesies, yaitu :
- asam-asam keras memilih bersenyawa dengan basa-basa keras,
- asam-asam lunak memilih bersenyawa dengan basa-basa lunak.
Tabel Klasifikasi beberapa asam basa berdasar HSAB (Bowser, 1993 )
Peranan HSAB
- meramalkan terjadi tidaknya suatu reaksi melalui suka tidak suka, yaitu asam keras cenderung suka dengan basa keras dan asam lunak cenderung suka dengan basa lunak.
Contoh :
HgF2(g) + BeI2(g) → HgI2(g) + BeF2(g)
LK KL LL KK
CH3HgOH(aq) + HSO3-(aq) → CH3HgSO3-(aq) + HOH(l)
LK KL LL KK
- meramalkan pergeseran arah suatu reaksi (kesetimbangan),
BH+(aq) + CH3Hg+(aq) ↔ CH3HgB+(aq) + H+(aq)
B = basa
Dari contoh diatas, apabila basa (B) adalah basa keras maka reaksi akan bergeser ke arah kiri dan apabila basa (B) adalah basa lunak maka reaksi akan bergeser ke arah kanan.
Teori Asam Basa Lux – Flood
Asam adalah aseptor oksida
Basa adalah donor oksida
Sebagai contoh, pada lelehan anorganik temperature tinggi, reaksinya sebagai berikut :
CaO + SiO2 —–> CaSiO3
Basa asam
Basa (CaO) —–> donor oksida
Asam (SiO2) —–> aseptor oksida
Kegunaan dari definisi Lux Flood adalah kebanyakan terbatas pada sistem seperti lelehan oksida, Zat bersifat amfoter jika zat tersebut menunjukkan sebuah kecenderungan keduanya untuk memberikan ion oksida bergantung pada kondisi, yaitu:
-
Teori Asam Basa Usanovic
Asam adalah senyawa kimia yang bereaksi dengan basa, membentuk kation atau menerima elektron.
Contoh:
Cl2 + 2e- ——> 2Cl-
Cl2 bertindak sebagai asam karena menerima satu elektron sehingga membentuk 2Cl-.
Basa adalah senyawa kimia yang bereaksi dengan asam, membentuk anion atau melepaskan elektron.
Contoh:
Fe2+ (basa) ——> Fe3+ (asam) + e-
Fe2+ bertindak sebagai basa karena melepaskan satu elektron sehingga membentuk Fe3+.
Kelebihan :
Memperluas teori asam basa menurut Lewis sehingga senyawa yang belum diidentifikasi menurut Lewis bisa diidentifikasi melalui teori asam basa Usanovich
Jenis Senyawa Asam dan Basa
Senyawa Asam
Berdasarkan jumlah ion H+ yang dilepas, senyawa asam dikelompokkan menjadi:
a ; Asam monoprotik adalah asam yang melepaskan satu ion H+
Contoh: HNO3, HBr, CH3COOH.
b; Asam poliprotik adalah asam yang melepaskan lebih dari satu ion H+
Contoh: H2S, H2SO4, H3PO4
Berdasarkan kemampuan senyawa asam untuk bereaksi dengan air membentuk ion H+, senyawa asam dibedakan menjadi:
a ; Asam biner adalah asam yang mengandung unsur H dan unsur nonlogam lainnya (hidrida nonlogam).
Contoh: HCl, HBr, HF
b; Asam oksi adalah asam yang mengandunh unsur H, O dan unsur lainnya.
Contoh: HNO3, H2SO4, HClO2
c ; Asam organik adalah asam yang tergolong senyawa organik.
Contoh: CH3COOH, HCOOH
Macam-Macam Indikator Asam Basa
-
Indikator Tunggal
Indikator tunggal hanya dapat membedakan larutan bersifat asam atau basa, tetapi tidak dapat mengetahui harga pH dan pOH. Yang termasuk indikator tunggal adalah lakmus merah, lakmus biru, fenolftlein, metil jingga, metil merah, dan bromtimul biru.
Perubahan warna yang terjadi sebagai berikut
| Kertas Lakmus/ Larutan Indikator | Warna dalam larutan | Trayek pH | ||
| Asam | Basa | |||
| Lakmus Biru
Lakmus Merah |
Merah
Merah |
Biru
Biru |
0-7
7-14 |
|
| Fenolftalein (PP)
Metil Jingga Metil Merah Bromtimul Biru (BB) |
Tak berwarna
Merah Merah Kuning |
Merah muda
Kuning Kuning Biru |
8,3-10
2,9-4,0 4,2-6,3 6,0-7,6 |
|
-
Indikator Alam
Di alam banyak ditemukan indikator asam basa yang berasal dari tumbuh-tumbuhan. Bagian tumbuhan yang dapat digunakan antara lain mahkota bunga, daun, dan akar. Berikut bahan-bahan alami indikator asam dan basa:
- Bunga Sepatu
- Hydrangea
- Kunyit
- Bunga Trompet
- Wortel
- Kol Merah
- Kulit Manggis
- Kubis Ungu
Bahan-bahan alami diatas tidak dapat langsung digunakan sebagai indikator, agar dapat digunakan sebagai indikator harus dibuat dalam bentuk larutan dengan cara mengekstraknya.
Kemudian ke dalam larutan indikator alami tersebut ditetesi larutan asam dan basa. Perubahan warna yang terjadi disetiap indikator alami bermacam-macam.
-
pH meter
Merupakan alat yang digunakan untuk mengukur pH larutan denga mencelupkan elektrode ke dalam larutan. pH-meter akan emngukur adanya ion hidrogen yang ditunjukan pada skala pH-meter. Dengan alat ini kita jadi lebih mudah untuk menentukan sifat asam atau basa suatu larutan.
-
Indikator Universal
Indikator universal dapat membedakan larutan asam atau basa dengan mengetahui harga pH dari larutan tersebut. Indikator universal dapat dalam bentuk kertas dan cairan.
Cara kerja indikator ini dengan mencocokan perubahan warna kertas indikator pada tabel warna indikator universal.
Warna indikator universal pada berbagai pH sebagai berikut.
| pH | Warna Indikator Universal | pH | Warna Indikator universal |
| 1
2 3 4 5 6 7 |
Merah
Merah lebih muda Merah muda Merah jingga Jingga Kuning Hijau |
8
9 10 11 12 13 14 |
Merah
Merah lebih muda Merah muda Merah jingga Jingga Kuning Hijau |
-
Larutan Indikator
Larutan indikator yang paling sering digunakan di berbagai laboratorium adalah fenolptalein (PP), metil merah (mm), metil jingga (mo) dan juga bromtimol blue (BTB). Larutan-larutan tersebut sering digunakan dalam proses titrasi larutan. Penggunaan larutan indikator dalam proses titrasi larutan harus dilakukan dengan sangat teliti dan pengamatan yang sangat tinggi. Hal ini dikarenakan perubahan warna akan terjadi hanya dengan beberapa mL saja. Berikut merupakan penjelasan dari tiap jenis larutan indikator:
-
Phenol Ptalein (PP)
indikator ini dibuat dengan cara kondensasi anhidrida ftalein atau asam ftalat dengan fenol. Memiliki trayek pH sebesar 8,2 – 10,0 dengan asam yang tidak berwarna dan berwarna merah muda pada larutan basa.
-
Metil Merah (mm)
Indikator metil merah adalah salah satu indikator asam basa yang memiliki warna merah dalam asam dan jingga dalam basa dengan trayek pH 4,2 – 6,3.
-
Metil Jinga (mo)
Indikator metil jingga merupakan salah satu indikator asam basa yang akan berwarna merah dalam asam dan berwarna jingga dalam basa dengan trayek pH 3,1 – 4,4.
-
Bromtimol Blue (BTB)
Indikator BTB merupakan salah satu indikator yang akan berwarna merah kuning dalam larutan asam dan biru dalam larutan yang bersifat basa dengan trayek pH 6,0 – 7,6.
-
Indikator Campuran
Untuk beberapa titrasi tertentu, kadang harus dilakukan dengan menggunakan indikator campuran. Yang dimaksud dengan indikator campuran adalah campuran antara dua jenis indikator atau antara sebuah indikator dengan suatu zat warna biasa yang bukan merupakan indikator pH. Indikator campuran ini tidak dapat berubah warna seperti indikator yang lainnya, tetapi pada pH tertentu warnanya akan hilang dalam akan menjadi hitam yang dalam pengerjaannya terlihat kelabu.
Warna ini akan terlihat jelas perbedaannya dari warna pada pH sedikit di atas atau pun di bawahnya, sehingga akan mempermudah dalam menentukan larutan sudah mencapai pH tersebut atau belum. Indikator campuran digunakan apabila indikator biasa tidak bisa menunjukkan perbedaan warna asam dan warna basa dengan jelas sehingga perubahan warna yang terjadi pun tidak terlihat jelas.
-
Indikator asam basa buatan
Apakah LUMUT KERAK termasuk asam, basa atau netral?
Sebenarnya, untuk mengetahui asam atau basanya suatu zat dapat dicicipi dengan menggunakan lidah. Akan tetapi, perlu kita ingat juga bahwa tidak semua zat aman bagi tubuh kita. Masih ingatkah kalian bahwa ada bahan kimia yang bersifat racun?
Berdasarkan hal tersebut di atas, maka untuk keperluan eksperimen, para ilmuan menciptakan lakmus. Lakmus adalah sejenis zat yang di peroleh dari jenis lumut kerak/liken (Rocella tinctoria), suatu simbiosis jamur dan alga. Lakmus yang banyak digunakan dalam laboratorium-laboratorium kimia sekarang ini tersedia dalam bentuk kertas. Sebagai indikator asam-basa, lakmus memiliki beberapa kelebihan antara lain adalah sebagai berikut:
- Lakmus dapat berubah warnanya dengan cepat saat bereaksi dengan asam maupun basa. Warna yang terjadi pada lakmus dapat terlihat jelas. Lakmus akan berwarna merah dalam larutan asam dan akan berwarna biru dalam larutan basa.
- Lakmus sukar bereaksi dengan oksigen dalam udara bebas, sehingga dapat bertahan lama.
- Lakmus mudah di serap oleh kertas, sehingga di gunakan dalam bentuk kertas lakmus (agar zat lebih mudah meresap)
Kertas lakmus jenisnya ada dua, yaitu kertas lakmus merah & kertas lakmus biru.
Semua zat tergolong asam apabila :
- lakmus biru berubah menjadi merah, atau
- lakmus merah tidak berubah warna
Semua zat tergolong basa apabila :
- lakmus merah menjadi biru, atau
- lakmus biru tidak berubah warna
Indikator Asam Basa
| Nama Indikator | Dalam Basa | Dalam Asam |
| Lakmus Metil merah Fenolftalen Brom timol biru |
biru kuning merah biru |
merah merah tak berwarna kuning |
Selain lakmus, dalam laboratorium kimia juga masih banyak lagi indikator asam-basa buatan antara lain fenolftalen, metil merah dan brom timol biru. Fenolftalen dalam larutan asam tetap (tak berubah warnanya), sedangkan dalam larutan basa berubah menjadi warna merah. Metil merah dalam larutan asam berwarna merah sedangkan dalam larutan basa berwarna kuning.
Indikator asam basa buatan: indikator yang dibuat di laboratorium, indikator buatan ada yang berbentuk cair dan kertas.
Perubahan Warna dan rentang pHindikator buatan dalam larutan Asam dan Basa
| Indikator | Wujud | Asam | Basa | Rentang pH |
| Lakmus | Kertas | Merah | Biru | 5,5 – 8,0 |
| Metil jingga | Cair | Merah | Kuning | 3,1 – 4,4 |
| Metil merah | Cair | Merah | Kuning | 4,4 – 6,2 |
| Bromtimol biru | Cair | Kuning | Biru | 6,0 – 7,6 |
| Fenolftalein | Cair | Tidak berwarna | Merah | 8,3 – 10,0 |
Baik indikator buatan maupun alami digunakan untuk mengindikasi (mengetahui) ada tidaknya asam atau basa dalam sampel.
-
Indikator Asam Basa Alami
Indikator alam merupakan bahan-bahan alam yang dapat berubah warnanya dalam larutan asam, basa, dan netral. Indikator alam yang biasanya dilakukan dalam pengujian asam basa adalah tumbuhan yang berwarna mencolok, berupa bunga-bungaan, umbi-umbian, kulit buah, dan dedaunan. Perubahan warna indikator bergantung pada warna jenis tanamannya, misalnya kembang sepatu merah di dalam larutan asam akan berwarna merah dan di dalam larutan basa akan berwarna hijau, kol ungu di dalam larutan asam akan berwarna merah keunguan dan di dalam larutan basa akan berwarna hijau.
Indikator asam basa alami: indikator yang berasal dair bahan-bahan alami, cara memperolehnya dengan mengekstrak
Perubahan Warna dari Ekstrak Tanaman dalam Larutan Asam dan Basa
| Ekstrak tanaman | Warna asli | Perubahan warna dlm larutan asam | Perubahan warna dlm larutan basa |
| Kubis merah | Ungu/merah lembayung | Merah muda | Hijau |
| Bunga sepatu | Merah tua | Merah | Kuning |
| Bunga mawar | Merah muda | Merah muda | Hijau |
| Bayam merah | Merah | Merah muda | Kuning |
| Geranium | Merah | Jingga tua/orange | Kuning |
| Kunyit | Jingga tua/orange | Kuning | Merah |
| Bunga pacar | Jingga tua/orange | Merah | kuning |
Membuat Indikator Asam-Basa Alami
Indikator asam-basa yang baik adalah zat warna yang memberi warna berbeda dalam larutan asam dan larutan basa. Bagimanakah cara membuat indikator alami? Di bawah ini, beberapa cara pembuatan indikator alami dengan menggunakan bunga sepatu, bunga hidrangea, kol merah, kunyit, dan bayam merah.
- Cara pembuatan indikator alami dari bunga sepatu
- Pilihlah beberapa helai mahkota bunga berwarna merah dari bunga sepatu.
- Gerus dalam lumpang dengan sedikit air.
- Saring ekstrak mahkota bunga merah tersebut.
- Cara pembuatan indikator alami dari bunga Hidrangea
- Pilihlah beberapa helai mahkota bunga Hidrangea
- Gerus dalam lumpang dengan sedikit air.
- Saring ekstrak mahkota bunga Hidrangea tersebut.
- Cara pembuatan indikator alami dari kol merah
- Haluskan sejumlah kol merah yang masih segar
- Rebus selama 10 menit
- Biarkan air kol merah menjadi dingin
- Saring dalam toples besar
- Cara pembuatan indikator alami dari kunyit
- Parut kunyit yang telah dibersihkan
- Saring ekstrak kunyit dengan alkohol menggunakan kain ke dalam mangkok kecil
- Cara pembuatan indikator alami dari bayam merah
- Bayam merah diiris kecil-kecil, rendam dalam air suling yang sudah dipanaskan,
- Di tunggu sampai air berwarna ungu.
- Saring dan diamkan dalam suhu ruang sampai dingin.
- Indikator dapat disimpan dalam lemari es jika tidak digunakan.
DAFTAR PUSTAKA
Brady, E., James. 1999. Kimia Universitas Asas dan Struktur Jilid II. BinarupaAksara:
Jakarta
Chang, Raymond. 2004. Kimia Dasar jilid II. Jakarta: Erlangga
Hanson, David M. 2008. General Chemistry. Hanson: United States of America
Nurlita, Frieda., Suja, I Wayan. Buku Ajar Kimia Dasar II. Singaraja: Jurusan Pendidikan
Kimia, FMIPA, Undiksha.
Tatika, Kanindya. 2015. Super Trik Kimia Dahsyat SMA Kelas 10, 11, 12. Yogyakarta:
Forum Edukasi
https://belajardarisoal.blogspot.com/2016/07/pengertian-indikator-asam-basa-dan.html
Raharjoe, Susanto l, 1985, larutan dan kinetika kimia, Bandung; ITB, hal 1-42
http://www.chem-is-try.org/materi_kimia/kimia_dasar/asam_dan_basa/sifat-sifat-asam-basa-dan-garam/
http://unitedscience.wordpress.com/ipa-1/bab-2-asam-basa-dan-garam/
http://blog.elevenia.co.id/jenis-jenis-indikator-asam-basa-yang-paling-lengkap/
Itulah ulasan tentang Pengertian Dan Macam-Macam Indikator Asam Basa Secara Lengkap. Semoga apa yang diulas diatas bermanfaat bagi pembaca. Sekian dan Terima Kasih.
Baca juga refrensi artikel terkaitnya disini :