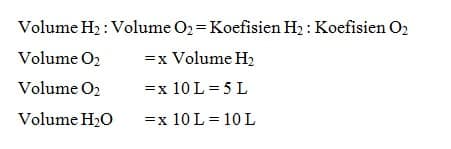Pengertian Stoikiometri
Stoikiometri berasal dari bahasa Yunani yaitu stoiceon (unsur) dan metrein (mengukur).Stoikiometri berarti mengukur unsur-unsur dalam hal ini adalah partikel atom ion, molekul yang terdapat dalam unsur atau senyawa yang terlibat dalam reaksi kimia.Stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) yang didasarkan pada hukum-hukum dasar dan persamaan reaksi.
Stoikiometri beberapa reaksi dapat dipelajari dengan mudah, salah satunya dengan metode JOB atau metode Variasi Kontinu, yang mekanismenya yaitu dengan dilakukan pengamatan terhadap kuantitas molar pereaksi yang berubah-ubah, namun molar totalnya sama. Sifat fisika tertentunya (massa, volume, suhu, daya serap) diperiksa, dan perubahannya digunakan untuk meramal stoikiometri sistem. Dari grafik aluran sifat fisik terhadap kuantitas pereaksi, akan diperoleh titik maksimal atau minimal yang sesuai titik stoikiometri sistem, yang menyatakan perbandingan pereaksi-pereaksi dalam senyawa.
Stoikiometri reaksi adalah penentuan perbandingan massa unsur-unsur dalam senyawa dalam pembentukan senyawanya. Pada perhitungan kimia secara stoikiometri, biasanya diperlukan hukum-hukum dasar ilmu kimia.Hukum kimia adalah hukum alam yang relevan dengan bidang kimia. Konsep paling fundamental dalam kimia adalah hukum konservasi massa, yang menyatakan bahwa tidak terjadi perubahan kuantitas materi sewaktu reaksi kimia biasa.
Stoikiometri ialah cabang kimia yang berhubungan dengan suatu hubungan kuantitatif yang terdapat antara reaktan dan juga produk dalam reaksi kimia. Reaktan ialah suatu zat yang berpartisipasi didalam reaksi kimia, dan juga produk ialah suatu zat yang diperoleh sebagai hasil dari reaksi kimia.
Stoikiometri tersebut bergantung pada kenyataan ialah bahwa unsur-unsur berperilaku dengan cara yang bisa atau dapat diprediksi, dan juga materi yang tidak dapat diciptakan atau juga dihancurkan. Oleh Sebab itu, pada saat unsur digabungkan kemudian menghasilkan reaksi kimia, sesuatu yang dikenal dan juga spesifik yang akan terjadi serta hasil reaksi bisa untuk diprediksi dengan berdasarkan unsur-unsur dan juga jumlah yang terlibat. Stoikiometri ialah matematika di balik ilmu kimia.
Perhitungan stoikiometri tersebut bisa menemukan bagaimana unsur-unsur dan juga komponen yang diencerkan dalam suatu larutan yang konsentrasinya diketahui, bereaksi didalam kondisi eksperimental. Kata “Stoikiometri” tersebut berasal dari kata “stoicheion” Yunani, berarti “unsur” dan juga “metron” berarti “ukuran”.
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Reaksi Kimia
Perhitungan Stoikiometri
Pada awal abad ke-19, banyak penelitian dilakukan terhadap sifat gas.Salah seorang peneliti sifat gas yaitu ahli kimia berkebangsaan Prancis yang bernama Joseph Louis Gay Lussac (1778 – 1850). Pada tahun 1808, ia melakukan serangkaian percobaan untuk mengukur volume gas-gas yang bereaksi. Disimpulkannya bahwa pada temperatur dan tekanan sama, perbandingan volume gas-gas yang bereaksi dan volume gas hasil reaksi merupakan perbandingan bilangan bulat dan sederhana. Temuan Gay Lussac ini dikenal sebagai hukum perbandingan volume.
-
Penentuan Volume Gas Pereaksi dan Hasil Reaksi
Pertanyaan yang timbul setelah Gay Lussac mengemukakan hukum perbandingan volume dapat dipecahkan oleh seorang ahli fisika Italia yang bernama Amadeo Avogadro pada tahun 1811.
Menurut Avogadro: ”Gas-gas yang volumenya sama, jika diukur pada suhu dan tekanan yang sama, akan memiliki jumlah molekul yang sama pula”.
Oleh karena perbandingan volume gas hidrogen, gas oksigen, dan uap air pada reaksi pembentukan uap air = 2 : 1 : 2 maka perbandingan jumlah molekul hidrogen, oksigen, dan uap air juga 2 : 1 : 2. Jumlah atom tiap unsur tidak berkurang atau bertambah dalam reaksi kimia.Oleh karena itu, molekul gas hidrogen dan molekul gas oksigen harus merupakan molekul dwiatom, sedangkan molekul uap air harus merupakan molekul triatom.
Perbandingan volume gas dalam suatu reaksi sesuai dengan koefisien reaksi gas-gas tersebut. Hal ini berarti bahwa, jika volume salah satu gas diketahui, volume gas yang lain dapat ditentukan dengan cara membandingkan koefisien reaksinya.
Contoh : Pada reaksi pembentukan air
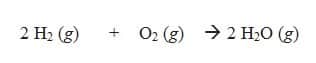 Jika volume gas H2 yang diukur pada suhu 25°C dan tekanan 1 atm sebanyak 10 L volume gas O2 dan H2O pada tekanan dan suhu yang sama dapat ditentukan dengan cara sebagai berikut.
Jika volume gas H2 yang diukur pada suhu 25°C dan tekanan 1 atm sebanyak 10 L volume gas O2 dan H2O pada tekanan dan suhu yang sama dapat ditentukan dengan cara sebagai berikut.
-
Massa Atom Relatif dan Massa Molekul Realtif
Setelah ditemukan peralatan yang sangat peka di awal abad XX, para ahli kimia melakukan percobaan tentang massa satu atom. Sebagai contoh, dilakukan percobaan untuk mengukur.
- massa satu atom H = 1,66 x 10–24 g
- massa satu atom O = 2,70 x 10–23 g
- massa satu atom C = 1,99 x 10–23 g
Dari data di atas dapat dilihat bahwa massa satu atom sangat kecil. Para ahli sepakat menggunakan besaran Satuan Massa Atom (sma) atau Atomic Massa Unit (amu) atau biasa disebut juga satuan Dalton.Pada materi struktur atom, Anda telah mempelajari juga bahwa atom sangatlah kecil, oleh karena itu tidak mungkin menimbang atom dengan menggunakan neraca.
a. Massa Atom Relatif (Ar)
Para ahli menggunakan isotop karbon C–12 sebagai standar dengan massa atom relatif sebesar 12. Massa atom relatif menyatakan perbandingan massa rata-rata satu atom suatu unsur terhadap 1/12 massa atom C–12. Atau dapat dituliskan:
1 satuan massa atom (amu) = 1/12 massa 1 atom C–12
Contoh: Massa atom rata-rata oksigen 1,33 kali lebih besar dari pada massa atom C –12.
Maka: Ar O = 1,33x Ar C–12
= 1,33x 12
= 15,96
Para ahli membandingkan massa atom yang berbeda-beda, menggunakan skala massa atom relatif lambang ”Ar”.
Para ahli memutuskan untuk menggunakan C–12 atau isotop 12C karena mempunyai kestabilan inti yang inert dibanding atom lainnya. Isotop atom C–12 mempunyai massa atom 12 sma. Satu sma sama dengan 1,6605655x 10–24 g. Dengan digunakannya isotop 12C sebagai standar maka dapat ditentukan massa atom unsur yang lain. Massa atom relatif suatu unsur (Ar) adalah bilangan yang menyatakan perbandingan massa satu atom unsur tersebut dengan 1/12 massa satu atom C–12.
b. Massa Molekul Relatif (Mr)
Molekul merupakan gabungan dari beberapa unsur dengan perbandingan tertentu. Unsur-unsur yang sama bergabung membentuk molekul unsur, sedangkan unsur-unsur yang berbeda membentuk molekul senyawa. Massa molekul unsur atau senyawa dinyatakan oleh massa molekul (Mr). Massa molekul relatif adalah perbandingan massa molekul unsur Massa molekul dapat dihitung dengan menjumlahkan Ar dari atom-atom pembentuk molekul tersebut.
Mr = r atom penyusun
-
Konsep Mol dan Tetapan Avogadro
Apabila Anda mereaksikan satu atom karbon (C) dengan satu molekul oksigen (O2) maka akan terbentuk satu molekul CO2. Tetapi sebenarnya yang Anda reaksikan bukan satu atom karbon dengan satu molekul oksigen, melainkan sejumlah besar atom karbon dan sejumlah besar molekul oksigen. Oleh karena jumlah atom atau jumlah molekul yang bereaksi begitu besarnya maka untuk menyatakannya, para ahli kimia menggunakan ”mol” sebagai satuan jumlah partikel (molekul, atom, atau ion).
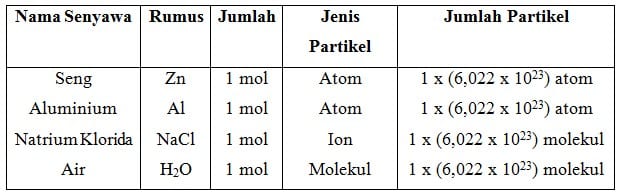
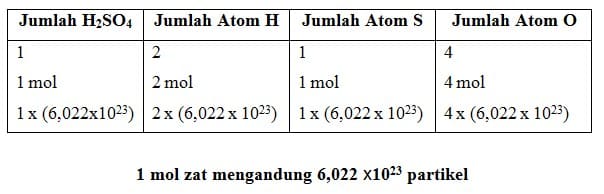
Satu mol didefinisikan sebagai jumlah zat yang mengandung partikel zat itu sebanyak atom yang terdapat dalam 12,000 g atom karbon –12.Jadi, dalam satu mol suatu zat terdapat 6,022 x 1023 partikel.Nilai 6,022 x 1023 partikel per mol disebut sebagai tetapan Avogadro, dengan lambang L atau N.
Dalam kehidupan sehari-hari, mol dapat dianalogikan sebagai ”lusin”. Jika lusin menyatakan jumlah 12 buah, mol menyatakan jumlah 6,022 x 1023 partikel zat. Kata partikel pada NaCl, H2O, dan N2 dapat dinyatakan dengan ion dan molekul, sedangkan pada unsur seperti Zn, C, dan Al dapat dinyatakan dengan atom.
Rumus kimia suatu senyawa menunjukkan perbandingan jumlah atom yang ada dalam senyawa tersebut.
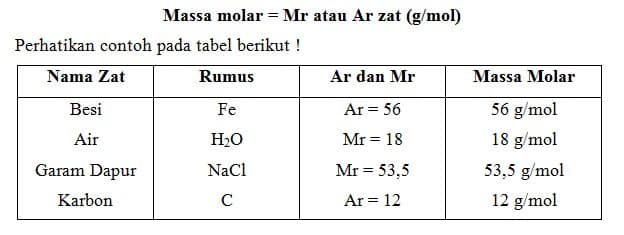
a. Massa Molar (Mr)
Massa satu mol zat dinamakan massa molar (lambang Mr). Besarnya massa molar zat adalah massa atom relatif atau massa molekul relatif zat yang dinyatakan dalam satuan gram per mol.
Massa suatu zat merupakan perkalian massa molarnya (g/mol) dengan mol zat tersebut (n). Jadi hubungan mol suatu zat dengan massanya dapat dinyataka sebagai berikut.
Massa molar = massa : mol
Massa = mol x Mr/Ar (massa molar)
b. Volume Molar (Vm)
Volume satu mol zat dalam wujud gas dinamakan volume molar, yang dilambangkan dengan Vm.Berapakah volume molar gas?Bagaimana menghitung volume sejumlah tertentu gas pada suhu dan tekanan tertentu? Avogadro dalam percobaannya mendapat kesimpulan bahwa 1 L gas oksigen pada suhu 0° C dan tekanan 1 atm mempunyai massa 1,4286 g, atau dapat dinyatakan bahwa pada tekanan 1 atm:
1 L gas O2= mol
1 L gas O2= mol
1 mol gas O2= liter
Maka, berdasarkan hukum Avogadro dapat disimpulkan:
1 mol gas O2 = 22,4 L
Sesuai dengan hukum Avogadro yang menyatakan bahwa pada suhu dan tekanan yang sama, volume gas yang sama mengandung jumlah molekul yang sama atau banyaknya mol dari tiap-tiap gas volumenya sama. Berdasarkan hukum tersebut berlaku volume 1 mol setiap gas dalam keadaan standar (suhu 0° C dan tekanan 1 atm) sebagai berikut.
Volume gas dalam keadaan standar = 22,4 L
c. Volume gas pada keadaan tidak standar
Perhitungan volume gas tidak dalam keadaan standar (non-STP) digunakan dua pendekatan sebagai berikut.
Persamaan Gas Ideal
Dengan mengandaikan gas yang akan diukur bersifat ideal, persamaan yang menghubungkan jumlah mol (n) gas, tekanan, suhu, dan volume yaitu:
Hukum gas ideal : P . V = n .R . T
P = tekanan (satuan atmosfir, atm)
V = volume (satuan liter, L)
n = jumlah mol gas (satuan mol)
R = tetapan gas (0,08205 L atm/mol K)
T = suhu mutlak (°C + 273,15 K)
P.V = n.R.T
Jika, n = 1 mol
R = 0,08205 L atm/mol K
P = 1 atm
T = 273 K
V = 22,4 L
d. Molaritas (M)
Banyaknya zat yang terdapat dalam suatu larutan dapat diketahui dengan menggunakan konsentrasi larutan yang dinyatakan dalam molaritas (M).Molaritas menyatakan banyaknya mol zat dalam 1 L larutan.Secara matematis dinyatakan sebagai berikut.
M = x
Di mana:
M = molaritas (satuan M)
massa = dalam satuan g
Mr = massa molar (satuan g/mol)
V = volume (satuan mL)
-
Rumus Molekul dan Kadar Unsur Dalam Senyawa
Perbandingan massa dan kadar unsur dalam suatu senyawa dapat ditentukan dari rumus molekulnya.
Kadar unsur = x 100%
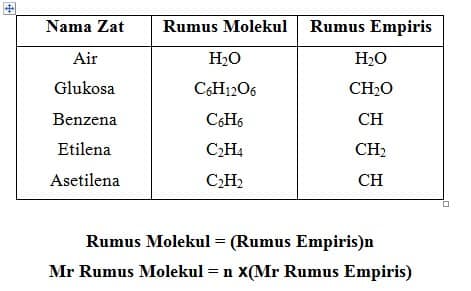
a. Penentuan Rumus Empiris dan Rumus Molekul
Rumus kimia menunjukkan jenis atom unsur dan jumlah relatif masing-masing unsur yang terdapat dalam zat.Banyaknya unsur yang terdapat dalam zat ditunjukkan dengan angka indeks.
Rumus kimia dapat berupa rumus empiris dan rumus molekul.”Rumus empiris, rumus yang menyatakan perbandingan terkecil atom-atom dari unsur-unsur yang menyusun senyawa”.”Rumus molekul, rumus yamg menyatakan jumlah atom-atom dari unsur-unsur yang menyusun satu molekul senyawa”.Perhatikan contoh rumus molekul dan rumus empiris beberapa senyawa dalam tabel berikut.
n = bilangan bulat
Penentuan rumus empiris dan rumus molekul suatu senyawa dapat ditempuh dengan langkah berikut.
- Cari massa (persentase) tiap unsur penyusun senyawa,
- Ubah ke satuan mol,
- Perbandingan mol tiap unsur merupakan rumus empiris,
- Cari rumus molekul dengan cara: (Mr rumus empiris)n = Mr rumus molekul, n dapat dihitung,
- Kalikan n yang diperoleh dari hitungan dengan rumus empiris.
b. Menentukan Rumus Kimia Hidrat (Air Kristal)
Hidrat adalah senyawa kristal padat yang mengandung air kristal (H2O). Rumus kimia senyawa kristal padat sudah diketahui. Jadi pada dasarnya penentuan rumus hidrat merupakan penentuan jumlah molekul air kristal (H2O) atau nilai x. Secara umum, rumus hidrat dapat ditulis sebagai berikut.
Rumus kimia senyawa kristal padat : x . H2O
Sebagai contoh garam kalsium sulfat, memiliki rumus kimia CaSO4 .2H2O, artinya dalam setiap satu mol CaSO4 terdapat 2 mol H2O.
c. Hitungan Kimia
Penentuan jumlah pereaksi dan hasil reaksi yang terlibat dalam reaksi harus diperhitungkan dalam satuan mol. Artinya, satuan-satuan yang diketahui harus diubah ke dalam bentuk mol. Metode ini disebut metode pendekatan mol. Adapun langkah-langkah metode pendekatan mol tersebut dapat Anda simak dalam bagan berikut.
- Tuliskan persamaan reaksi dari soal yang ditanyakan dan setarakan.
- Ubahlah semua satuan yang diketahui dari tiap-tiap zat ke dalam mol.
- Gunakanlah koefisien reaksi untuk menyeimbangkan banyaknya mol zat reaktan dan produk.
- Ubahlah satuan mol dari zat yang ditanyakan ke dalam satuan yang ditanya (L atau g atau partikel, dll.).
d. Pereaksi Pembatas
Di dalam suatu reaksi kimia, perbandingan mol zat-zat pereaksi yang dicampurkan tidak selalu sama dengan perbandingan koefisien reaksinya. Hal ini berarti bahwa ada zat pereaksi yang akan habis bereaksi lebih dahulu. Pereaksi demikian disebut pereaksi pembatas.Bagaimana hal ini dapat terjadi? Anda perhatikan gambar di bawah ini!
X + 2Y à XY2
X = molekul zat X
Y = molekul zat Y
XY = molekul zat XY2
Reaksi di atas memperlihatkan bahwa menurut koefisien reaksi, satu mol zat X membutuhkan dua mol zat Y. Gambar di atas menunjukkan bahwa tiga molekul zat X direaksikan dengan empat molekul zat Y. Setelah reaksi berlangsung, banyaknya molekul zat X yang bereaksi hanya dua molekul dan satu molekul tersisa. Sementara itu, empat molekul zat Y habis bereaksi.Maka zat Y ini disebut pereaksi pembatas.
Pereaksi pembatas merupakan reaktan yang habis bereaksi dan tidak bersisa di akhir reaksi.Dalam hitungan kimia, pereaksi pembatas dapat ditentukan dengan cara membagi semua mol reaktan dengan koefisiennya, lalu pereaksi yang mempunyai nilai hasil bagi terkecil merupakan pereaksi pembatas.
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Unsur Kimia Beserta Sifat dan Fungsinya
Hukum Stoikiometri.
Stoikiometri tersebut bersandar pada hukum ialah seperti hukum perbandingan tetap, hukum perbandingan ganda dan juga hukum kekekalan massa.
- Hukum kekekalan massa
Dengan menggunakan hukum-hukum fisika ialah seperti hukum kekekalan massa, yang menggemukakn bahwa massa reaktan itu sama dengan massa produk, Stoikiometri digunakan untuk dapat mengumpulkan informasi mengenai jumlah berbagai unsur yang digunakan didalam suatu reaksi kimia ,
-
Hukum perbandingan tetap
Hukum Ini menyatakan ialah bahwa senyawa kimia tersebut (zat yang terdiri atas 2(dua) atau juga lebih usnur) yang selalu berisi proporsi yang sama dari suatu unsur (senyawa dengan satu jenis atom) dengan massa.
-
Hukum perbandingan berganda
Hukum Ini ialah salah satu hukum dasar stoikiometri, disamping dari hukum perbandingan tetap. Kadang-kadang juga disebut dengan hukum Dalton. Dikatakan ialah bahwa, jika 2(dua) unsur tersebut membentuk lebih dari 1 senyawa antara mereka, maka rasio massa dari suatu unsur kedua yang bergabung dengan massa tetap atas unsur pertama keduanya tersebut akan mempunyai rasio sejumlah kecil dari keseluruhan.
Penjelasan hukum Stoikiometri
Dengan berdasarkan hukum-hukum di atas tersebut, reaksi kimia tersebut dapat menggabungkan dalam rasio bahan kimia yang pasti. Jumlah pada tiap-tiap unsur tersebut harus sama di seluruh reaksi. Dalam reaksi kimia yang seimbang, hubungan antara jumlah reaktan dan juga produk biasanya akan membentuk rasio bilangan bulat. Misalnya ialah , dalam suatu reaksi yang membentuk amonia (NH3), tepatnya 1(satu) molekul nitrogen (N2) bereaksi ialah dengan 3(tiga) molekul hidrogen (H2) untuk dapat menghasilkan 2 molekul NH3. Hal tersebut dapat digambarkan sebagai berikut
N2 + 3H2 ——-> 2NH3
Maka, Stoikiometri tersebut dapat digunakan untuk dapat menghitung jumlah ialah seperti jumlah produk yang dapat diproduksi apabila diberikan reaktan dan juga persentase reaktan yang dibuat menjadi suatu produk diketahui.
Baca Juga Artikel Yang Mungkin Berhubungan : Laju Reaksi : Pengertian, Rumus, Contoh Soal Dan Faktor Yang Mempengaruhi
Jenis Stoikiometri
Stoikiometri Reaksi
toikiometri tersebut sering digunakan untuk dapat menyeimbangkan persamaan kimia yang dapat ditemukan pada stoikiometri reaksi. Hal tesebut menggambarkan bahwa hubungan kuantitatif antara zat disebabkan karena mereka berpartisipasi dalam reaksi kimia.
Stoikiometri Komposisi
Stoikiometri komposisi ini menjelaskan ialah kuantitatif (massa) hubungan antara suatu unsur-unsur dalam senyawa. Misalnya ialah, stoikiometri komposisi tersebut menggambarkan (massa) nitrogen dengan hidrogen yang bergabung dan menjadi amonia kompleks. yakni 1 mol nitrogen dan juga 3 mol hidrogen dalam tiap-tiap 2 mol amonia. Mol ialah satuan yang digunakan didalam kimia untuk jumlah zat.
Stoikiometri Gas
Jenis stoikiometri ialah berkaitan dengan suatu reaksi yang melibatkan gas, yang mana gas berada pada suatu suhu, tekanan dan juga volume yang dikenal dan juga dapat dianggap gas ideal. Untuk gas, perbandingan volume idealnya tersebut sama dengan hukum gas ideal, Namun rasio massa reaksi tunggal tersebut harus dihitung dari massa molekul reaktan serta juga produk,yang mana massa molekul ialah massa 1(satu) molekul zat.
Gas ideal ialah suatu gas teoretis yang terdiri dari 1(satu) set partikel yang bergerak acak, tanpa-berinteraksi yang mematuhi suatu hukum gas ideal. Hukum gas ideal ialah suatu persamaan keadaan gas ideal. Persamaan hukum gas ideal ialah sebagai berikut :
“PV = nRT, yang mana P ialah tekanan, V ialah volume dan juga T ialah temperatur absolut, n ialah mol gas dan juga R ialah konstanta gas universal”.
Baca Juga Artikel Yang Mungkin Berhubungan : √ Makalah Ikatan Kimia : Pengertian, Jenis Beserta Gambarnya Lengkap
Rasio Stoikiometri
Sejumlah stoikiometri atau juga rasio reagen (zat yang ditambahkan ke suatu sistem dalam rangka untuk menciptakan suatu reaksi kimia) ialah jumlah atau juga rasio yang mana, dengan asumsi ialah bahwa hasil suatu reaksi selesai dengan dasar , antara lain ialah sebagai berikut:
- Semua reagen yang dikonsumsi
- Tidak terdapat defisit reagen
- Tidak terdapat sisa-sisa residu
- Reaksi hanya akan terjadi atau tercipta pada rasio stoikiometri