Pengertian Reaksi Kimia, Ciri, Faktor, Tahapan, Macam & Contohnya. Reaksi kimia adalah peristiwa perubahan kimia dari zat yang bereaksi menjadi zat-zat hasil reaksi.

Pengertian Reaksi Kimia
Reaksi kimia adalah peristiwa perubahan kimia dari zat-zat yang bereaksi (reaktan) menjadi zat-zat hasil reaksi (produk). Pada reaksi kimia selalu dihasilkan zat-zat yang baru dengan sifat-sifat yang baru. Reaksi kimia dituliskan dengan menggunakan lambang unsur. Marilah kita lihat bagaimana cara menyatakan suatu reaksi dengan menggunakan lambang.
Perhatikan reaksi merkuri oksida yang menghasilkan merkuri dan oksigen berikut.
HgO —— Hg + O2
Ahli kimia akan menerjemahkan lambang-lambang di atas sebagai berikut. “Molekul HgO yang terdiri dari satu atom merkuri (Hg) ditambah satu atom oksigen (O), menghasilkan (——) satu molekul yang terdiri dari satu atom merkuri (Hg) ditambah satu molekul yang terdiri dari dua atom oksigen (O2)”.
Gabungan lambang yang menunjukkan suatu reaksi kimia dinamakan persamaan kimia. Zat yang bereaksi di sebelah kiri anak panah disebut pereaksi sedangkan zat di sebelah kanan anak panah disebut hasil reaksi. Jadi, HgO pada persamaan kimia di atas adalah pereaksi. Hg dan O2 adalah hasil reaksi.
Hukum konservasi materi menyatakan bahwa dalam reaksi kimia biasa tidak ada materi yang hilang meskipun mungkin berubah. Jumlah atom dalam pereaksi hams tetap sama dengan yang dihasilkan, betapa pun atom-atom itu berubah untuk membentuk pola molekul yang baru. Apabila suatu persamaan memenuhi syarat-syarat itu, dapat dikatakan persamaan itu setimbang.
Bagaimana dengan persamaan
HgO —— Hg + O2?
Untuk mengimbangkan persamaan, kita tambahkan angka 2 sebelum HgO dan angka 2 lagi sebelum Hg. 2HgO berarti dua molekul yang masing-masing terdiri dari satu atom merkuri dan satu atom oksigen. Persamaan itu sekarang menjadi:
2 HgO — 2 Hg + O2
Dengan kata lain, dua molekul merkuri oksida (HgO) yang masing- masing terdiri dari satu atom merkuri dan satu atom oksigen menghasilkan dua molekul merkuri yang masingmasing terdiri dari satu atom merkuri ditambah satu molekul oksigen, yang terdiri dari dua atom oksigen.
Persamaan ini sekarang telah setimbang, di sebelah kiri ada dua atom merkuri dan dua atom oksigen, demikian juga di sebelah kanan. Perhatikan bahwa dalam hasil reaksi ditulis 2 Hg, bukan Hg2. Hal ini karena molekul merkuri hanya terdiri dari satu atom merkuri.
Kalau angka 2 kita tuliskan di bawah, berarti kita mengatakan bahwa molekul itu mengandung dua atom dan ini keliru. Ingat bahwa dalam menyeimbangkan persamaan kita tidak boleh mengganti molekul. Kita hanya boleh mengubah jumlah molekul.
Baca Juga Artikel Yang Mungkin Berhubungan : Termokimia : Pengertian, Sistem, Reaksi, Dan Rumus Serta Contohnya Lengkap
Ciri-Ciri Reaksi Kimia
Ketika terjadi reaksi kimia, terdapat perubahan-perubahan yang dapat kita amati. Perhatikan ciri-ciri reaksi kimia berikut.
-
Reaksi Kimia dapat Menimbulkan Perubahan Warna
Sebagai contoh kita dapat mengamati bahwa warna ungu pada larutan kalium permanganat (KMnO4) akan berubah jika direaksikan dengan larutan asam oksalat (H2C2O4). Perubahan kimia ini terjadi karena senyawa kalium permanganat berubah menjadi senyawa mangan sulfat (MnSO4) yang tidak berwarna.
Demikian juga dengan tembaga karbonat (CuCO3) yang berwarna hijau akan berubah menjadi tembaga oksida (Cu2O) yang berwarna kehitaman dan karbon dioksida (CO2) setelah dipanaskan.
-
Reaksi Kimia dapat Membentuk Endapan
Ketika barium klorida (BaCh) direaksikan dengan natrium sulfat (Na2SO4) akan menghasilkan suatu endapan putih barium sulfat (BaSO4). Endapan putih yang terbentuk ini sukar larut dalam air. Reaksi kimia tersebut dapat dituliskan sebagai berikut.
BaCl2 + Na2SO4 —— BaSO4+ 2NaCl
(larutan) (larutan) (padatan) (larutan)
Banyak sekali zat-zat kimia yang direaksikan menimbulkan endapan. Contoh lain adalah larutan perak nitrat (AgNO3) direaksikan dengan larutan natrium klorida (NaCl) menghasilkan endapan putih perak klorida (AgCl) dan larutan natrium nitrat (NaNO3).
AgNO3 + NaCl — AgCl+ NaNO3
(larutan) (larutan) (padatan) (larutan)
Sebenarnya apakah endapan itu? Endapan adalah zat yang memisahkan diri sebagai fase padat dari larutan. Endapan dapat berupa kristal (kristalin) atau koloid dan dapat dikeluarkan dari larutan dengan penyaringan atau sentrifugasi. Endapan terbentuk jika larutan menjadi terlalu jenuh dengan zat terlarut. Kelarutan suatu endapan sama dengan konsentrasi molar dari larutan jenuhnya.
Kelarutan endapan bertambah besar dengan kenaikan suhu, meskipun dalam beberapa hal khusus (seperti kalium sulfat), terjadi sebaliknya. Laju kenaikan kelarutan dengan suhu berbeda-beda. Pada beberapa hal, perubahan kelarutan dengan berubahnya suhu dapat menjadi alasan pemisahan.
Misal pemisahan ion timbal dari perak dan merkurium (I) dapat dicapai dengan mengendapkan ketiga ion itu mula- mula sebagai klorida, diteruskan dengan menambahkan air panas pada campuran. Air panas akan melarutkan timbale klorida (PbCh) tetapi perak dan raksa (I) klorida (HgCl) tidak larut di dalamnya. Setelah menyaring larutan panas tersebut, ion timbal akan ditemukan dalam filtrat.
-
Reaksi Kimia dapat Menimbulkan Perubahan Suhu
Kamu dapat membuktikan bahwa reaksi kimia dapat menyebabkan perubahan suhu. Pada percobaan mereaksikan asam sulfat (H2SO4) dan natrium hidroksida (NaOH) terjadi kenaikan suhu. Nah, reaksi kimia yang menghasilkan kenaikan suhu dinamakan reaksi eksoterm.
Reaksi eksoterm dapat kamu temukan pada pembakaran kertas dan pembakaran bensin pada kendaraan bermotor.
Pada percobaan kedua, saat kamu mereaksikan campuran barium hidroksida (Ba(OH)2) dan amonium klorida (NH4Cl), larutan tersebut akan menyerap panas di sekitarnya sehingga terjadi penurunan suhu. Reaksi kimia yang menyerap panas di sekitarnya dinamakan reaksi endoterm. Contoh reaksi endoterm dalam kehidupan sehari-hari adalah fotosintesis dan memasak makanan.
-
Reaksi Kimia dapat Menimbulkan Gas
Pernahkah kamu melarutkan tablet vitamin berkalsium tinggi (tablet effervescent) ke dalam segelas air? Ketika kamu melarutkan tablet vitamin berkalsium tinggi ke dalam segelas air, kamu akan melihat gelembung-gelembung gas muncul dari dalam larutan. Hal ini membuktikan bahwa dalam peristiwa reaksi kimia dapat menimbulkan gas. Selain contoh di atas, kamu juga dapat mengamati reaksi kimia yang menghasilkan gas pada saat kamu membuka kaleng minuman berkarbonasi.
Baca Juga Artikel Yang Mungkin Berhubungan : Campuran : Pengertian, Ciri, Dan Macam Serta Contohnya Dalam Ilmu Kimia
Tahapan dan Faktor Memengaruhi Reaksi Kimia
Tahukah kamu berapa lama suatu reaksi kimia dapat berlangsung? Berdasarkan laju reaksinya, maka reaksi kimia ada yang berlangsung cepat, dan ada pula yang berlangsung lambat.
Contoh reaksi kimia yang berlangsung cepat adalah reaksi kimia pada tablet effervescent ketika dilarutkan dalam air, dan menyalakan kembang api. Adapun contoh reaksi kimia yang berlangsung lambat adalah proses korosi atau berkaratnya besi, reaksi pembuatan tempe dan tape.
Bagaimana cara mengukur laju reaksi kimia? Laju reaksi kimia dapat ditentukan dengan mengukur berkurangnya jumlah reaktan yang bereaksi atau pertambahan jumlah produk yang terbentuk tiap satuan waktu tertentu. Laju reaksi kimia dipengaruhi oleh beberapa factor, antara lain sebagai
berikut:
-
Pengaruh Ukuran Zat terhadap Laju Reaksi
Menurutmu, manakah yang akan lebih cepat larut, satu bongkah garam atau satu sendok garam halus? Ketika kamu melarutkan satu bongkah garam dan satu sendok garam halus masing-masing ke dalam segelas air, maka garam halus akan lebih cepat larut dibandingkan garam bongkahan. Hal ini dikarenakan ukuran butiran garam halus lebih kecil dari ukuran bongkahan garam.
-
Pengaruh Suhu terhadap Laju Reaksi
Pemberian kalor atau pemanasan pada suatu reaksi kimia memengaruhi laju reaksi. Pada reaksi eksoterm bila suhu tinggi reaksi menjadi lambat, sedangkan pada reaksi endoterm, bila suhu tinggi reaksi menjadi cepat.
Dalam reaksi endoterm, pada suhu tinggi, partikel-partikel zat akan bergerak lebih cepat daripada suhu rendah. Hal inilah yang menyebabkan reaksi kimia berjalan lebih cepat. Reaksi kimia terjadi ketika molekul-molekul dan atom-atom bertumbukan.
Menaikkan suhu berarti menaikkan energi kinetik partikel, sehingga partikel tersebut bergerak lebih cepat dan lebih sering bertumbukan. Inilah sebabnya mengapa laju reaksi pada reaksi endoterm lebih cepat pada suhu yang tinggi.
-
Katalis
Beberapa reaksi berlangsung secara lambat meskipun suhu tinggi dan kontak antara zat yang bereaksi intensif. Dalam kasus seperti ini, zat lain yang tidak terlibat dalam reaksi dapat mempercepat perubahan kimia. Zat lain ini disebut katalis. Katalis umumnya zat padat, tetapi dapat juga berupa zat cair atau gas. Katalis mengubah laju reaksi, tetapi tidak memengaruhi hasil reaksi.
Hal ini dapat dituliskan:
A + B + Z ^ AB + Z
Jika zat A direaksikan dengan zat B dengan katalis Z, maka pada akhir reaksi diperoleh produk reaksi AB dan katalis Z.
Berbagai katalis dipergunakan untuk mengubah laju bermacam-macam reaksi. Sel-sel hidup mempunyai katalis reaksi yang disebut enzim yang memungkinkan terjadinya reaksi kimia di dalam sel.
Enzim hanya dapat bekerja dengan baik pada keadaan tertentu misalnya suhu dan tingkat keasaman tertentu. Contoh enzim amilase yang berada dalam air ludah sebagai katalis dari pereaksi pati yang menghasilkan produk reaksi maltosa.
Ahli kimia sering menggunakan katalis. Kadang-kadang, ditambahkannya sedikit saja katalis pada zat-zat yang bereaksi. Misalnya, menggabungkan serbuk nikel yang halus dengan minyak biji kapas agar minyak itu bereaksi dengan hidrogen untuk menghasilkan lemak padat yang dipergunakan sebagai bahan penyusut atau dipergunakan untuk pembuatan sabun.
Campuran udara dan belerang dioksida yang melalui katalis serbuk platina akan bereaksi dengan cepat dan menghasilkan belerang trioksida (SO3).
Baca Juga Artikel Yang Mungkin Berhubungan : √ Makalah Ikatan Kimia : Pengertian, Jenis Beserta Gambarnya Lengkap
Macam Reaksi Kimia
Dengan mengetahui beberapa sifat atau jenis reaksi, kita dapat memahami reaksi-reaksi kimia lebih mudah. Umumnya, reaksi-reaksi kimia digolongkan menurut jenisnya sebagai berikut:
1. Reaksi penggabungan
2. Reaksi penguraian
3. Reaksi pergantian (reaksi pertukaran tunggal)
4. Reaksi Metatesis (reaksi pertukaran ganda)
REAKSI PENGGABUNGAN
Reaksi penggabungan adalah reaksi dimana dua buah zat bergabung membentuk zat ketiga. Kasus paling sederhana adalah bila dua unsur bereaksi membentuk senyawa. Misalnya logam natrium bereaksi dengan gas klor membentuk natrium klorida.
Persamaan reaksinya:
2Na(s) +Cl2(g) — 2NaCl(s)
Contoh lain misalnya reaksi antara fosfor putih dan gas klor. Dalam jumlah klor terbatas,fosfor bereaksi membentuk fosfor triklorida, PCl3, suatu cairan tak berwarna.
P4(s) + 6Cl2(g) – 4PCl3(l)
Jika klor yang tersedia berlebih, maka senyawa fosfor yang dihasilkan adalah fosfor pentaklorida, PCl5, suatu zat padat berwarna putih.
P4(s) + 10Cl2(g) – 4PCl5(s)
Reaksi penggabungan lain melibatkan senyawa sebagai pereaksi. Misalnya: fosfor triklorida bereaksi dengan gas klor membentuk fosfor pentaklorida.
Persamaan reaksinya:
PCl3(l) + Cl2(g) – PCis(s)
REAKSI PENGURAIAN
Reaksi penguraian adalah reaksi bila senyawa tunggal bereaksi membentuk dua atau lebih zat. Biasanya reaksi ini membutuhkan kenaikan suhu agar senyawa yang dapat terurai dengan menaikkan suhu misalnya KclO3. Senyawa ini bila dipanaskan akan terurai menjadi KCl dan gas oksigen.
Persamaan reaksinya:
KClO3(s) — 2KCl(s) + 3O2(g)
Penguraian kalium klorat biasa digunakan untuk membangkitkan gas oksigen secara laboratorium.
Reaksi penguraian biasa diterapkan dalam pengolahan batu kapur di daerah cipatat Jawa Barat. Batu kapur,CaCO3 hasil penggalian agar dapat dimanfaatkan sebagai bahan bangunan perlu diolah lebih lanjut dijadikan batu tohor, CaO. Pengolahan batu kapur ini dilakukan dengan cara pemanggangan batu kapur dalam tungku.
Persamaan kimia yang terjadi adalah:
CaCO3(s) — CaO(s) + CO2(g)
Pada reaksi ini, senyawa tunggal diuraikan menjadi dua zat yang berbeda.
REAKSI PERTUKARAN
Reaksi pergantian atau disebut juga reaksi pertukaran tunggal adalah reaksi dimana suatu unsur bereaksi dengan senyawa menggantikan unsur yang terdapat dalam senyawa itu. Misalnya, jika lempeng logam tembaga dicelupkan kedalam larutan perak nitrat, kristtal logam perak dihasilkan.
Persamaan reaksinya adalah :
Cu(s) + 2AgNO3(aq) ^ 2Ag(s) + Cu(NO3)2(aq)
Tembaga menggantikan perak yang terdapat dalam perak nitrat, menghasilkan larutan tembaga nitrat dan logam perak.
Jika lempeng logamseng dicelupkan ke dalam larutan tembaga sulfat yang berwarna biru,maka pada permukaan logam seng akan terbentuk endapan tembaga berwarna merah, dan warna biru dari larutan perlahan-lahan memudar. Hal ini menunjukan bahwa seng bereaksi dengan tembaga sulfat menghasilkan logam tembaga dan larutan seng sulfat yang tak berwarna.
Baca Juga Artikel Yang Mungkin Berhubungan : √ Karbon Monoksida: Pengertian, Struktur, Reaksi, Serta Peran Dalam Fisiologi Dan Makanan
REAKSI METATESIS
Reaksi metatesis atau reaksi pertukaran ganda adalah reaksi yang melibatkan pertukaran bagian dari pereaksi. Jika pereaksi adalah senyawa ionik dalam bentuk larutan, bagian yang bertukaran adalah kation dan anion dari senyawa. Misalnya larutan kalium iodida yang tak berwarna dicampurkan dengan larutan timbal (II) nitrat yang juga tak berwarna. Ion-ion di dalam larutan bereaksi membentuk endapan berwarna kuning dari senyawa timbal (II) iodida.
Persamaan reaksinya:
2KI(aq) +Pb(NO3)2(aq) ^ 2KNO3(aq) + PbI2(s)
Ion iodida dalam larutan kalium iodidabertukaran dengan ion nitrat dari larutan timbal (II) nitrat, menghasilkan larutan kalium nitrat yang tak berwarna dan padatan timbal (II) iodida berwarna kuning, sebagai PbI2.
Reaksi asam dan basa yang menghasilkan garam,juga dianggap sebagai reaksi metatesis. Misalnya reaksi antara asam hidroklorida, HCl(aq) dan natrium hidroksida (aq), persamaan reaksinya:
HCl(aq) + NaOH(aq) ^ NaCl(aq) + H2O(l)
Reaksi asam-basa disebut juga reaksi netralisasi, sebab padareaksi itu terjadi penertaan muatan H+ oleh OH- membentuk air (H2O) yang netral secara listrik. Garam NaCl yang terbentuk tetap berada dalam larutan sebagai ion-ionnya.
REAKSI PEMBAKARAN
Reaksi yang kita pertimbangkan sejauh ini dapat dikarakterisasi sebagai reaksi penata ulangan atom-atom. Namun demikian, kita perlu menambahkan satu jenis reaksi lain yaitu reaksi pembakaran, yang dicirikan oleh fakta bahwa salah satu pereaksinya adalah oksigen. Reaksi pembakaran dalah reaksi suatu zat dengan oksigen, biasanya bereaksi cepat disertai pelepasan kalor mambentuk nyala api.
Jika senyawa karbon dibakar dalam oksigen atau udara akan terbentuk karbon dioksida dan uap air bila pembakarannya sempurna. Tetapi, bila pembakaran kurang sempurna (kekurangan oksigen) akan terbentuk gas karbon monoksida, atau bolehjadi terbentuk karbon yang berwarna hitam (jelaga).
Beberapa contoh pembakaran senyawa karbon:
CH4(g) + 202(g) ^ CO2(g) + 2H2O(g)
2CH3OHO) + 302(g) – 2C02(g) + 4H20(g)
C4H10® + 1302(g) – 8C02(g) + 10H2O(g)
Perkaratan besi,walaupun tidak biasa dianggap sebagai pembakaran, secara esensi merupakan reaksi pembakaran, sebab terjadi reaksi antara besi dan oksigen disertai pelepasan energi. Reaksi perkaratan besi pada kenyataannya sangat kompleks melibatkan molekul air, tapi kita dapat menuliskan perkaratan dalam bentuk reaksi bersihnya, yaitu sebagai berikut:
4Fe(s) + 3O2(g) + nH2O(l) ^ 2Fe2O3.nH2O(s)
Demikian tulisan mengenai macam-macam reaksi kimia
Contoh Reaksi Kimia
Reaksi Kimia bisa terjadi di manapun di sekitar kita, bukan hanya di laboratorium. Materi berinteraksi untuk membentuk produk baru melalui proses yang disebut reaksi kimia atau perubahan kimiawi. Setiap kali kita memasak atau sedang bersih-bersih, itu juga merupakan kimia dalam tindakan. Tubuh kita hidup dan tumbuh berkat reaksi kimia. Ada reaksi ketika kita meminum obat, menyalakan korek api, dan mengambil napas.
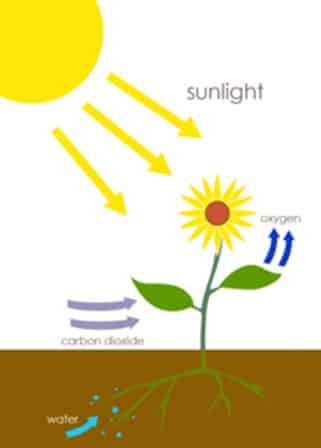
Fotosintesis
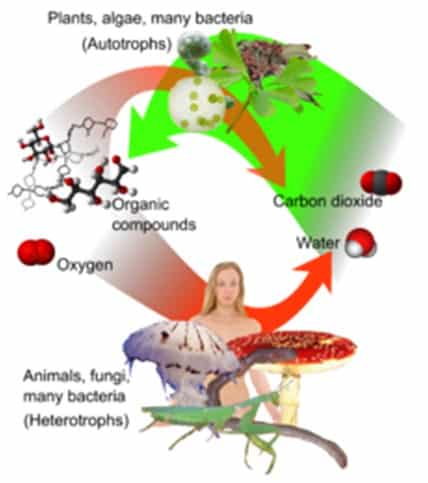
Fotosintesis adalah proses yang digunakan oleh tanaman dan organisme lain untuk mengubah energi cahaya, biasanya dari Matahari, menjadi energi kimia yang dapat kemudian dibebaskan untuk bahan bakar aktivitas organisme. Energi kimia ini disimpan dalam molekul karbohidrat, seperti gula, yang disintesis dari karbon dioksida dan air. Dalam kebanyakan kasus, oksigen juga dihasilkan sebagai produk limbahnya.
Kebanyakan tanaman, sebagian besar ganggang, dan cyanobacteria melakukan fotosintesis, dan organisme tersebut disebut photoautotrophs. Fotosintesis mempertahankan kadar oksigen atmosfer dan memasok semua senyawa organik dan sebagian besar energi yang diperlukan untuk kehidupan di Bumi.
Secara singkat, tanaman menggunakan reaksi kimia yang disebut fotosintesis untuk mengubah karbon dioksida dan air menjadi makanan (glukosa) dan oksigen. Ini adalah salah satu reaksi kimia sehari-hari yang paling umum dan juga salah satu yang paling penting, karena ini adalah bagaimana tanaman memproduksi makanan untuk diri mereka sendiri dan hewan dan mengubah karbon dioksida menjadi oksigen.
6 CO2 + 6 H2O + light → C6H12O6 + 6 O2
Respirasi Seluler Aerobik
Respirasi seluler aerobik adalah proses kebalikan dari fotosintesis dalam energi molekul digabungkan dengan oksigen yang kita hirup untuk melepaskan energi yang dibutuhkan oleh sel-sel kita ditambah karbon dioksida dan air. Energi yang digunakan oleh sel adalah energi kimia dalam bentuk ATP (adenosin trifosfat).
Respirasi aerobik membutuhkan oksigen untuk menghasilkan ATP. Meskipun karbohidrat, lemak, dan protein yang dikonsumsi sebagai reaktan, adalah metode yang disukai dalam pemecahan piruvat dalam glikolisis dan mengharuskan piruvat memasuki mitokondria untuk sepenuhnya teroksidasi oleh siklus Krebs.
Produk dari proses ini adalah karbon dioksida dan air, tetapi energi yang ditransfer digunakan untuk memecah ikatan yang kuat di ADP sebagai kelompok fosfat ketiga ditambahkan untuk membentuk ATP, oleh fosforilasi tingkat substrat, NADH dan FADH2
Berikut adalah persamaan keseluruhan untuk respirasi sel aerobik:
C6H12O6 + 6O2 → 6CO2 + 6H2O + energy (36 ATPs)
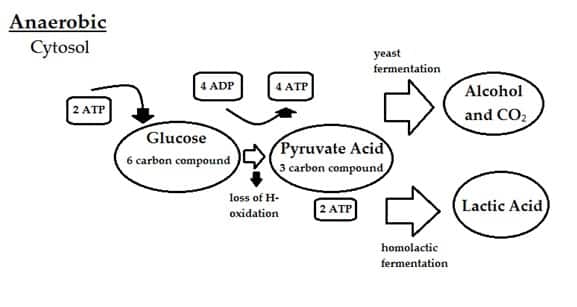
Respirasi Anaerobik
Berbeda dengan respirasi aerobik, respirasi anaerobik menggambarkan satu set reaksi kimia yang memungkinkan sel untuk mendapatkan energi dari molekul kompleks tanpa oksigen. Otot-otot sel melakukan respirasi anaerob setiap kali kita membuang oksigen yang kemudian sampai kepada mereka, seperti selama latihan intens atau berkepanjangan.
Respirasi anaerobik oleh ragi dan bakteri yang dimanfaatkan untuk fermentasi, untuk menghasilkan etanol, karbon dioksida, dan bahan kimia lain yang membuat keju, anggur, bir, yoghurt, roti, dan banyak produk umum lainnya.
Persamaan kimia secara keseluruhan untuk satu bentuk respirasi anaerobik adalah:
C6H12O6 → 2C2H5OH + 2CO2 + energy
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Fungsi dan Jenis-Jenis Vitamin Menurut Ahli Kimia
Pembakaran
Setiap kali kita menyalakan korek api, membakar lilin, membuat api, atau menyalakan panggangan, kita akan melihat reaksi pembakaran. Pembakaran menggabungkan molekul energik dengan oksigen untuk menghasilkan karbon dioksida dan air.
Sebagai contoh, reaksi pembakaran propana, ditemukan di panggangan gas dan beberapa perapian, adalah:
C3H8 + 5O2 → 4H2O + 3CO2 + energy
Karat
Karat adalah besi oksida, biasanya oksida merah yang dibentuk oleh reaksi redoks besi dan oksigen dengan adanya air atau kelembaban udara. Beberapa bentuk karat dibedakan baik secara visual maupun dengan spektroskopi, dan bentuk dalam keadaan yang berbeda. Karat terdiri dari besi terhidrasi (III) oksida Fe2O3 · nH2O dan besi (III) oksida-hidroksida (FeO (OH), Fe (OH ) 3).
Dalam waktu yang cukup, oksigen, dan air, setiap massa besi akhirnya akan mengkonversi seluruhnya karat dan hancur. Permukaan karat terkelupas dan rapuh, dan tidak memberikan perlindungan kepada besi dasar, seperti pembentukan patina pada permukaan tembaga. Karat adalah istilah umum untuk korosi besi dan paduannya, seperti baja. Banyak logam lainnya mengalami korosi yang setara, tetapi oksida yang dihasilkan tidak biasa disebut karat.
Berikut adalah persamaan kimia untuk karat besi:
Fe + O2 + H2O → Fe2O3. XH2O
Mencampur Bahan Kimia
Jika kita misal saja menggabungkan cuka dan baking soda untuk membuat gunung berapi kimia atau susu dengan baking powder dalam sebuah resep, kita mengalami perpindahan atau metatesis reaksi ganda (ditambah beberapa hal lain). Bahan bergabung kembali untuk menghasilkan gas karbon dioksida dan air. Bentuk karbon dioksida gelembung di gunung berapi dan dapat membantu peningkatan pemanggangan.
Reaksi-reaksi ini tampak sederhana dalam praktek, tetapi sering terdiri dari beberapa langkah. Berikut adalah persamaan kimia keseluruhan untuk reaksi antara baking soda dan cuka:
HC2H3O2 (aq) + NaHCO3 (aq) → NaC2H3O2 (aq) + H2O () + CO2 (g)
Baterai
Baterai adalah alat listrik-kimiawi yang menyimpan energi dan mengeluarkan tenaganya dalam bentuk listrik. Sebuah baterai biasanya terdiri dari tiga komponen penting, yaitu:
- batang karbon sebagai anode (kutub positif baterai)
- seng (Zn) sebagai katode (kutub negatif baterai)
- pasta sebagai elektrolit (penghantar)
Baterai menggunakan reaksi elektrokimia atau redoks untuk mengubah energi kimia menjadi energi listrik. Reaksi redoks spontan terjadi pada sel galvanik, sementara reaksi kimia tidak spontan terjadi dalam sel elektrolitik.
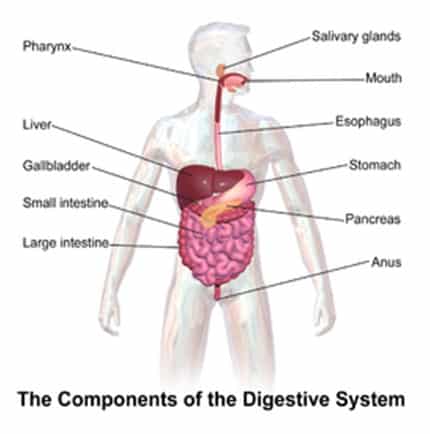
Pencernaan
Ribuan reaksi kimia terjadi selama proses pencernaan. Segera setelah kita menaruh makanan di mulut, enzim dalam air liur yang disebut amilase akan mulai memecah gula dan karbohidrat menjadi bentuk yang lebih sederhana supaya tubuh kita dapat menyerapnya.
Asam klorida dalam perut kita juga bereaksi dengan makanan untuk memecahnya, sedangkan enzim membelah protein dan lemak sehingga mereka dapat diserap ke dalam aliran darah melalui dinding usus.
Reaksi Asam-Basa
Setiap kali kita mencampur asam (misalnya, cuka, jus lemon, asam sulfat) dengan basa (misalnya, baking soda, sabun, amonia, aseton), kita melakukan reaksi asam-basa. Reaksi ini menetralkan asam dan basa menghasilkan garam dan air.
Natrium klorida bukan satu-satunya garam yang dapat dibentuk. Sebagai contoh, di sini adalah persamaan kimia untuk reaksi asam-basa yang menghasilkan kalium klorida, pengganti garam meja umum:
HCl + KOH → KCl + H2O
Sabun dan Deterjen
Sabun dan deterjen dapat membersihkan dengan menggunakan reaksi kimia. Sabun mengemulsi kotoran, yang berarti sabun mengikat noda minyak noda sehingga mereka dapat dibersihkan dengan air. Deterjen bertindak sebagai surfaktan, menurunkan tegangan permukaan air sehingga dapat berinteraksi dengan minyak, mengisolasi mereka, dan dan membersihkannya.