Enzim – Pengertian, Cara, Sifat, Faktor, Penamaan, Persyaratan, Contoh : Enzim bekerja dengan bereaksi dengan molekul substrat untuk menghasilkan senyawa antara melalui reaksi kimia organik yang membutuhkan energi aktivasi lebih rendah, sehingga mempercepat reaksi kimia terjadi karena reaksi kimia dengan energi aktivasi lebih tinggi membutuhkan waktu lebih lama.
Pengertian Enzim
Kata ‘enzim’ berasal dari bahasa Yunani en dan zyme. En berarti dalam dan zyme berarti ragi. Dengan demikian, enzim dapat diartikan sebagai zat dalam ragi. Yang dimaksud dengan enzim di sini adalah sekelompok protein yang mempunyai fungsi khusus yaitu sebagai biokatalis yang berfungsi untuk membantu proses metabolisme tubuh seperti pembentukan senyawa penyusun sel, pembakaran glukosa, penguraian protein, dan penguraian polisakarida.
Baca Juga Artikel Yang Mungkin Berhubungan : 6 Lembaga Agama : Pengertian, Contoh, Macam, Tujuan (LENGKAP)
Atau dapat dikatakan bahwa enzim adalah suatu protein yang berfungsi sebagai katalisator dalam reaksi pemecahan dan pembentukan (metabolisme) suatu zat yang terjadi di dalam sel suatu jaringan. Katalisator adalah suatu zat yang mempengaruhi kecepatan reaksi tanpa mempengaruhi hasil akhirnya. Zat itu sendiri tidak ikut dalam reaksi sehingga bentuknya tidak berubah.
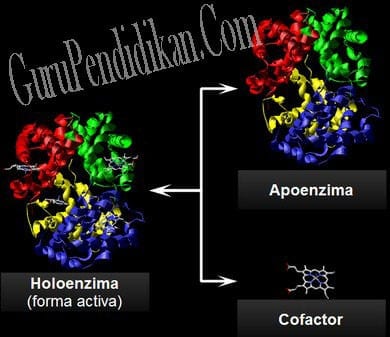
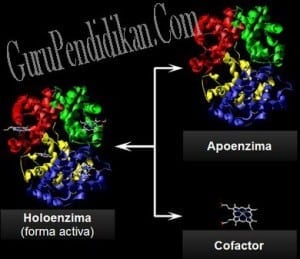
Enzim merupakan senyawa protein yang memiliki molekul besar. Beberapa enzim hanya terdiri dari polipeptida dan tidak mengandung gugus kimia selain residu asam amino. Namun, ada enzim lain yang memerlukan tambahan komponen untuk aktivitasnya.
Komponen ini disebut gugus prostetik. Gugus prostetik adalah ion atau molekul yang diperlukan oleh beberapa enzim untuk melakukan proses katalis. Gugus prostetik dapat berupa molekul anorganik (kofaktor) seperti ion Fe2+, Mn2+, atau Zn2+; atau berupa molekul organik kompleks (koenzim), seperti vitamin (B1, B2, B6, niasin, dan biotin). Koenzim tidak terpengaruh oleh pemanasan atau bersifat termostabil.
Banyak enzim terdiri atas bagian protein dan bagian lain yang bukan protein. Bagian protein enzim disebut apoenzim, bagian ini terdenaturasi oleh pemanasan. Enzim yang strukturnya sempurna dan aktif, bersama-sama dengan koenzim atau gugus logamnya disebut holoenzim.
Baca Juga Artikel Yang Mungkin Berhubungan : Lembaga Pendidikan : Pengertian, Macam Dan 6 Fungsi Lengkap
-
Cara Kerja Enzim
Salah satu ciri khas enzim adalah cara bekerjanya secara spesifik. Artinya, enzim hanya dapat bekerja pada substrat tertentu. Bagaimana cara kerja enzim? Ada dua teori yang menjelaskan tentang cara kerja enzim sebagai berikut:
-
Lock and Key Theory (Model Gembok dan Kunci)
Dikemukakan oleh Fischer (1898). Enzim diumpamakan sebagai gembok yang mempunyai bagian kecil yang dapat mengikat substrat (ibaratnya lubang pada gembok tempat memasukkan kunci). Bagian enzim yang dapat berikatan dengan substrat disebut sisi aktif.
Substrat diumpamakan kunci yang dapat berikatan dengan sisi aktif enzim.
-
Induced Fit Theory (Teori Ketepatan Induksi)
Sisi aktif enzim bersifat fleksibel sehingga dapat berubah bentuk menyesuaikan bentuk substrat.
Telah dijelaskan sebelumnya bahwa enzim adalah protein katalis. Katalis merupakan suatu agen kimia yang merubah kecepatan reaksi tanpa ikut berubah akibat reaksi tersebut. Enzim mampu melakukan hal tersebut berdasarkan pengaruhnya terhadap energi aktivasi yang dibutuhkan oleh setiap reaksi kimia. Energi aktivasi adalah energi yang dibutuhkan untuk memecahkan molekul senyawa reaktan.
Peranan enzim adalah menurunkan batasan energi aktivasi yang dibutuhkan untuk memulai reaksi. Turunnya batasan energi ini memungkinkan reaksi kimia terjadi pada temperatur yang lebih rendah. Hal ini menjadi sangat penting karena sebagian besar molekul yang berkaitan dengan proses kehidupan sangat sensitif terhadap suhu tinggi.
Baca Juga Artikel Yang Mungkin Berhubungan : Lembaga Keluarga : Pengertian Dan 4 Tahapannya ( LENGKAP )
Sifat-sifat Enzim
Enzim mempunyai sifat-sifat sebagai berikut:
-
Enzim merupakan biokatalisator
Enzim dapat mempercepat reaksi tetapi tidak ikut bereaksi. Hal ini berarti enzim tidak diperlukan dalam jumlah banyak. Dalam jumlah sedikit saja enzim telah dapat menyelenggarakan suatu perubahan zat yang beribu-ribu kali lebih berat dari berat molekulnya sendiri.
-
Enzim bekerja secara spesifik
Enzim tidak dapat bekerja pada semua zat atau substrat, tetapi hanya bekerja pada substrat tertentu saja. Misalnya, enzim katalase hanya mampu menghidrolisis H2O2 menjadi H2O dan O2, bukan substrat yang lain.
-
Enzim berupa koloid
Enzim adalah protein sehingga dalam larutan, enzim membentuk suatu koloid. Hal ini menambah luas bidang permukaan enzim sehingga bidang aktivitasnya lebih besar.
-
Enzim dapat bereaksi dengan substrat asam maupun basa
Sisi aktif enzim mempunyai gugus R residu asam amino spesifik yang merupakan pemberi atau penerima proton yang baik.
-
Enzim bersifat termolabil
Aktivitas enzim dipengaruhi oleh suhu. Dalam batas-batas tertentu, makin tinggi suhu akan mempercepat reaksi kimia yang dipengaruhi enzim. Sebaliknya, jika suhu makin rendah, reaksinya makin lambat.
-
Kerja enzim bersifat bolak-balik (irreversible)
Enzim tidak dapat menentukan arah dari reaksi, tetapi hanya mempercepat laju reaksi sehingga reaksi mencapai keseimbangan. Misalnya, enzim lipase dapat mengubah lemak menjadi asam lemak dan gliserol. Sebaliknya, lipase juga mampu menyatukan gliserol dan asam lemak menjadi lemak.
Faktor-faktor yang Mempengaruhi Aktivitas Enzim
Beberapa faktor yang mempengaruhi aktivitas enzim sebagai berikut:
-
Suhu (Temperatur)
Aktivitas enzim dipengaruhi oleh suhu. Aktivitas enzim semakin meningkat dengan makin tingginya suhu hingga batas optimum. Oleh karena enzim tersusun dari protein, pada temperatur tinggi dan melebihi batas optimum dapat menyebabkan denaturasi protein yang berarti enzim telah rusak. Pada suhu 0oC enzim tidak aktif, tetapi tidak juga rusak. Jika temperatur dikembalikan ke kondisi normal, enzim akan aktif kembali. Suhu optimum untuk aktivittas enzim pada manusia dan hewan berdarah panas adalah 37oC, sedangkan pada hewan berdarah dingin 25oC.
Kemampuan kerja enzim akan menurun di atas suhu tertentu. Hal ini disebabkan karena panas mengganggu ikatan hidrogen, ion dan berbagai ikatan yang menstabilkan bentuk aktif dari enzim, dan dengan demikian enzim yang merupakan protein mengalami proses denaturasi.
Baca Juga Artikel Yang Mungkin Berhubungan : Makalah Teks Debat
-
pH (Derajat Keasaman)
Tabel pH Optimum Berbagai Enzim
| Enzim | pH Optimum | Enzim | pH Optimum |
| Pepsin
Invertase Peroksidase Maltase |
2,0
4,5 5,0 7,0 |
Amilase
Urease Katalase Tripsin |
7,0
7,0 7,0 8,0 |
Enzim mempunyai pH optimum yang khas seperti tabel di atas. pH optimum enzim dapat berrsifat basa ataupun asam. Sebagian besar enzim pada manusia mempunyai pH optimum antara 6-8, misalnya enzim tripsin pendegradasi protein. Namun, ada beberapa enzim yang aktif pada kondisi asam, misalnya enzim pepsin.
Perubahan pH dapat mempengaruhi perubahan asam amino kunci pada sisi aktif sehingga menghalangi sisi aktif enzim berkombinasi dengan substratnya.
-
Konsentrasi Enzim dan Substrat
Pada umumnya konsentrasi enzim dan substrat berbanding lurus dengan kecepatan reaksi. Hal ini berarti jika konsentrasi enzim menjadi dua kali semula, sedangkan faktor lainnya tetap, kecepatan reaksi akan menjadi dua kali lipat.
Keadaan konstan dicapai apabila enzim sudah mengikat semua substrat yang akan dikatalisir, walaupun kadar enzim dinaikkan. Pada saat kadar enzim tetap, tetapi kadar substrat dinaikkan, kecepatan reaksi akan naik sampai dicapai kondisi konstan, yaitu ketika semua substrat sudah diikat oleh enzim.
-
Zat-zat Penggiat (Aktivator)
Terdapat zat kimia tertentu yang dapat meningkatkan aktivitas enzim. Misalnya, garam-garam dari logam alkali dalam konsentrasi encer (2% – 5%) dapat memacu kerja enzim. Demikian pula dengan ion logam Co, Mg, Ni, Mn, dan Ci. Hal ini mendukung teori Ketepatan Terinduksi.
-
Zat-zat Penghambat (Inhibitor)
Beberapa zat kimia dapat menghambat kerja enzim, misalnya garam-garam yang mengandung raksa (Hg) dan sianida (Cn). Ada tiga macam inhibitor sebagai berikut:
-
-
Inhibitor kompetitif
-
Pada penghambatan ini, zat-zat penghambat mempunyai struktur mirip dengan struktur substrat. Dengan demikian, zat penghambat dengan substrat saling berebut (bersaing) untuk bergabung dengan sisi aktif enzim. Proses penghambatan ini dapat diatasi dengan meningkatkan konsentrasi substrat.
-
-
Inhibitor nonkompetitif (inhibitor alosterik)
-
Inhibitor nonkompetitif dapat berikatan dengan enzim di luar sisi aktif sehingga enzim kehilangan aktivitasnya. Akibatnya, permukaan sisi aktif tidak dapat berikatan dengan substrat.
-
-
Inhibitor umpan-balik (feedback inhibitor)
-
Hasil akhir suatu reaksi akan menghambat bekerjanya enzim pada reaksi tersebut.
Penamaan Enzim
Enzim diberi nama dengan menambahkan akhiran –ase terhadap nama substrat yang diubah oleh enzim tersebut. Misalnya, enzim yang mengubah protein dinamakan protease atau enzim yang berperan dalam reduksi oksidasi dinamakan oksidase. Dapat juga berdasarkan penggabungan dari nama substrat dan jenis reaksi ditambah akhiran –ase, misalnya enzim laktat dehidrogenase.
Persyaratan agar Enzim dapat Bekerja Efektif
Aktivitas enzim sangat terpengaruh oleh keadaan suhu dan pH. masing-masing enzim dapat bekerja dengan efektif pada suhu dan pH tertentu dan aktivitasnya berkurang dalam keadaan di bawah atau di atas titik tersebut. Enzim pepsin pencerna protein bekerja paling efektif pada pH 1-2, sedangkan enzim proteolitik lainnya, tripsin, pada pH tersebut menjadi tidak aktif, tetapi sangat efektif pada pH 8. Terdapat dua peranan penting dalam kerja enzim, yaitu
- (1) peranan penting dari struktur tersier, yaitu bentuk, di dalam fungsi enzim,
- (2) peranan dari daya yang lemah seperti ikatan hydrogen dan ikatan ion dalam pembentukan struktur tersier, dapat menjelaskan mengapa enzim begitu peka terhadap suhu dan pH. Ikatan hydrogen mudah rusak dengan menaikkan suhu. Hal ini selanjutnya akan merusak bagian-bagian dari struktur tersier enzim yang esensial untuk menggikat substrat. Perubahan pH, mengubah keadaan ionisasi dari asam amino yang bermuatan (yaitu asam aspartat, Lisina) yang dapat mempunyai peranan penting dalam pengikatan substrat dan proses katalitik. Tanpa gugus –COOH dari Glu-35 yang tidak terion dan gugus COO– dari ASP-52 yang terion, proses katalitik dari lisozim akan terhenti.
Baca Juga Artikel Yang Mungkin Berhubungan : 25 Contoh Lembaga Pendidikan : Fungsi, Pengertian, Ciri