Pengertian Air
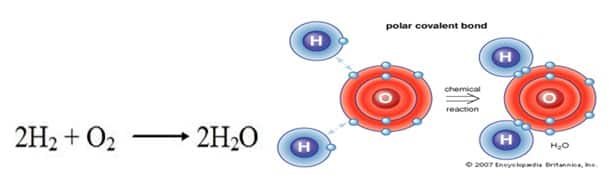
Air merupakan suatu molekul yang mengandung 2 atom hidrogen dan 1 atom oksigen yang berikatan secara kovalen. Di dalam organisme, air merupakan komponen terbesar. Air tidak hanya berperan penting dalam internal tubuh organisme, tetapi juga mempunyai peran penting di dalam lingkungan (Solomon 2011). Air merupakan molekul polar, dan mudah untuk dilihat. Selain itu, air termasuk substansi yang memiliki banyak sifat yang menguntungakan dan memiliki banyak kelebihan dibanding molekul-molekul lain. Molekul air memiliki bentuk yang sederhana menyerupai huruf v (Campbell 2005).
Air salah satu bahan yang sangat penting dalam suatu kehidupan. Yang ikatan hidrogen akan mengikat molekul-molekul air yang hingga menyatu. Saat air dalam wujud cair, ikatan hidrogen sangat rapuh yang sehingga ikatan-ikatan tersebut terbentuk, berpisah dan akan terbentuk kembali dengan sangat cepat. Dengan adanya ikatan hidrogen dapat menyusun molekul-molekul air tersebut sehingga akan memiliki sifat air yang bermanfaat. Beberapa bahan kimia tidak dapat membentuk suatu larutan, tetapi hanya terdispersi dalam air.
Baca Juga Artikel Yang Mungkin Berhubungan Daur Air (Siklus Hidrologi) : Pengertian, Proses Tahapan, Gambar
Peran Air dalam Kehidupan
1. Air Sebagai Pelarut
Dalam bentuk dispersi koloid, dimana partikel tidak mengendap maupun membentuk larutan. Protein senyawa yang dapat membentuk dispersi koloid, gelatin akan membentuk dispersi koloid bila ditambahkan air panas. Dalam suspensi, partikel bahan mempunyai ukuran yang besar, sehingga tidak larut dan tidak membentuk koloid, misalnya pati dalam air dingin.
Air mendispersi/melarutkan berbagai zat berdasarkan sifat dwi kutubnya, seperti NaCl (membentuk ion) selanjutnya beberapa zat yang tidak membentuk ion tapi termasuk dalam senyawa polar seperti aldehida, alkohol, dan gula dapat larut dalam air. Kelarutan dari zat seperti di atas disebabkan oleh adanya gugus hidroksil (alkohol dan gula) dan gugus oksigen karbonil (aldehida dan keton).
2. Mendispersi Senyawa Amfipatik
Air dapat mendispersi senyawa amfipatik (senyawa dengan gugus hidrofobik dan gugus hidrofilik) yang mempunyai gugus polar dalam molekulnya misalnya pada asam lemak. Sebagai contoh ialah garam Na-oleat. Natrium oleat mempunyai rantai hidrokarbon yang panjang, sehingga dapat dikatakan kecenderungan untuk terdispersi dalam air sangat sukar, tetapi kenyataannya bahwa rantai hidrokarbon yang panjang ini akan terdispersi di dalam air membentuk misel (disini air yang bersifat polar tidak melarutkan rantai hidrokarbon nonpolar pada asam oleat, sehingga terbentuklah misel) .
Dalam hal ini, gugus karboksilnya yang bermuatan negatif timbul di permukaan sedangkan rantai hidrokarbon yang nonpolar dan tidak larut berada dibagian dalam. Dalam bentuk misel, ada gaya tarik sesamanya melalui suatu interaksi Van der Walls yakni antara rantai hidrokarbon yang berdekatan, gaya tarik ini dikenal sebagai interaksi hidrofobik. Contoh lain komponen sel yang membentuk struktur nonpolar dengan bagian hidrofobiknya tersembunyi dari air adalah protein dan asam nukleat.
3. Pembekuan dan Struktur Es
Molekul air dapat mengikat empat molekul air dan menghasilkan kisi kristal heksagonal dalam es. Sifat ikatan hidrogen lain yang juga penting ialah bahwa ikatan ini terarah dengan baik dilihat dari susunan gabungan orbital antara atom hidrogen dan atom oksigen. Panjangnya ikatan hidrogen yang berbeda-beda sangat bergantung pada struktur geometri dan distribusi elektronnya. Bentuk es misalnya, tiap molekul air memiliki ikatan hidrogen dengan panjang 1,77 Å, tiap molekul air berikatan hidrogen dengan 4 tetangganya dengan jarak antara oksigen dengan oksigen 2,76 Å, sedangkan tiap molekul air akan berikatan hidrogen dengan 3 atau 4 molekul air lainnya dengan jarak oksigen ke oksigen 2,90 Å pada suhu 15 0C, dan 3,05 Å pada suhu 83 0C. Diperkirakan hanya 15 % ikatan hidrogen rusak jika es mencair pada suhu 0 0C. Ikatan yang kuat dalam molekul air ini masih ada walaupun air telah dipanaskan sampai 100 0C, ini dapat dilihat dengan tingginya panas penguapan air dan ikatan hidrogen ini hanya akan lepas secara tuntas jika air dipanaskan sampai 600 0C.
Kecenderungan untuk membentuk ikatan hidrogen terdapat juga antara tiap atom yang bermuatan negatif (misalnya oksigen, nitrogen, dan fluor) dengan hidrogen yang terikat kovalen pada atom bermuatan negatif lainnya. Ikatan hidrogen dapat terbentuk antara dua molekul tetapi dapat juga antara dua bagian yang berlainan dalam satu molekul. Jika di dalam air hanya terdapat satu ikatan hidrogen antara dua molekul zat yang larut, ikatan ini akan kalah bersaing dengan air sekelilingnya. Tetapi apabila antara dua struktur dalam air terdapat banyak ikatan hidrogen, maka diperlukan energi yang tinggi untuk melepaskannya, karena itu struktur tersebut sangat stabil dalam air, misalnya molekul protein atau asam nukleat dimana dalam molekulnya terdapat beratus-ratus bahkan beribu-ribu ikatan hidrogen.
4. Peran Air bagi Tumbuhan
Coba Anda bayangkan, kalau Anda mengamati sel, akan Anda dapati bagian paling luar adalah dinding sel, kemudian membran plasma. Sebelah dalam dari membran plasma akan didapati sitoplasma yang berupa cairan semikental yang di dalamnya terdapat banyak organel, seperti mitokondria, kloroplas, peroksisom, mikrotubul, dan sebagainya. Bagian paling tengah akan Anda jumpai vakuola berupa membran yang membungkus cairan berisi senyawa terlarut, seperti cadangan makanan atau zat warna tertentu. Dengan demikian praktis komponen terbesar dari sel adalah terdiri dari cairan. Itulah sebabnya maka sebagai fungsi pertama dari air adalah sebagai senyawa utama penyusun protoplasma. Protoplasma merupakan cairan utama penyusun sel, baik yang terdapat di dalam sitoplasma maupun vakuola sel.
Dalam kultur jaringan juga dikenal istilah kultur protoplas, yaitu apabila sel yang telah dihilangkan dinding selnya (tinggal membran plasma dan seluruh komponen di dalamnya meliputi sitoplasma, inti sel, dan vakuola) ditumbuhkan di dalam media kultur jaringan. Dengan demikian jelaslah betapa penting air bagi organisme, termasuk tumbuhan. Karena organisme tersusun oleh sel-sel dan jaringan, sementara komponen utama dari sel itu sendiri adalah air. Adapun perbedaan kadar air dari masing-masing jaringan dan organ tumbuhan, seperti tersebut di bagian sebelumnya adalah karena perbedaan dari sel-sel penyusunnya. Sel-sel penyusun buah yang memiliki vakuola besar yang berisi cadangan makanan akan banyak mengandung air, sementara sel-sel biji yang kering memiliki karakteristik yang berbeda, sel-selnya kecil dan telah mengalami dehidrasi sehingga kadar airnya rendah.
Selain itu air juga berfungsi sebagai pelarut hara mineral yang dibutuhkan bagi tumbuhan. Secara umum hara mineral merupakan ion bermuatan positif (seperti K+ , Ca++, NH4 + ) maupun negatif (NO3 – , SO3 = , HPO4 = ) yang terlarut di dalam air. Ion-ion tersebut bisa berasal dari bahan mineral tanah, dari hasil dekomposisi bahan organik atau mungkin berasal dari pupuk yang kita berikan. Air berperan penting dalam melarutkan ion-ion tersebut dari sumbernya sehingga bisa diserap oleh tumbuhan dan masuk ke dalam jaringan tumbuhan. Selain itu air yang cukup juga menjadi sarana yang baik bagi ion dan pupuk untuk berdifusi atau bergerak melalui aliran masa sehingga menjadi dekat dan tersedia bagi tumbuhan. Itulah sebabnya kekurangan air sering kali juga menyebabkan kekurangan hara pada tumbuhan karena kelarutan hara di dalam tanah menjadi sangat rendah. Dalam proses biokimia tumbuhan, air juga berfungsi penting sebagai medium reaksi maupun bahan bagi reaksi-reaksi metabolisme dalam tumbuhan. Banyak sekali reaksi-reaksi kimia di dalam sel tumbuhan memerlukan media air.
Dengan adanya kekurangan air menyebabkan terhambatnya banyak reaksi-reaksi metabolisme sehingga menghambat pertumbuhan tanaman. Dalam proses hidrolisis pati misalnya, pemecahan pati menjadi glukosa diperlukan air. Demikian juga reaksi-reaksi hidrolisis lainnya. Air juga mempunyai peran penting dalam proses reaksi terang fotosintesis. Dalam proses tersebut air merupakan sumber elektron, yaitu ketika molekul air dipecah untuk menghasilkan O2, H+ , dan elektron. Walaupun proporsi kebutuhan air dalam reaksi sangat kecil dibandingkan dengan kebutuhan pada reaksi-reaksi biokimia lainnya. Hal lain yang tidak kalah pentingnya adalah fungsi air dalam mempertahankan turgiditas sel, pertumbuhan sel dan pergerakan struktur tertentu dari tumbuhan. Turgiditas sel atau dikenal dengan istilah sel turgor adalah tekanan sel akibat masuknya air ke dalam sel. Ketika sel tanaman mengalami banyak kehilangan air sehingga menjadi layu maka pada saat tersebut sel mempunyai nilai tekanan turgor yang sama dengan nol.
Ketika air masuk ke dalam sel maka tekanan turgor akan meningkat (positif) dan sel akan mengembang sehingga sel mencapai ukuran yang maksimum. Ketika ini terjadi maka sel tumbuhan berada dalam keadaan turgor penuh. Pada pagi hari ketika air tanah atau media tanam cukup, biasanya sel-sel tumbuhan ada dalam keadaan turgor penuh. Pada tengah hari, saat matahari terik dan tumbuhan telah kehilangan banyak air akibat penguapan mungkin tumbuhan akan mengalami kehilangan tekanan turgor atau bahkan sampai mencapai nol (layu). Itulah peran air dalam hubungannya dengan turgiditas sel-sel tumbuhan.
Peran air yang demikian itu sangat penting karena tekanan turgor biasanya ada hubungannya dengan tingkat metabolisme tumbuhan. Ketika tumbuhan memiliki tekanan turgor yang tinggi (penuh) maka kemampuan metabolismenya juga tinggi, sebaliknya ketika tumbuhan kehilangan tekanan turgor (misalnya saat layu) maka kemampuan metabolismenya seperti fotosintesis dan respirasi juga rendah. Dengan demikian upaya mempertahankan turgor merupakan hal yang penting bagi tumbuhan.
Selain tekanan turgor, air juga penting dalam proses pembesaran dan pemanjangan sel. Coba Anda perhatikan, apabila tumbuhan kekurangan air maka tumbuhan biasanya kerdil, daunnya menjadi kecil-kecil dan jarak antar ruas-ruas batangnya juga menjadi lebih pendek. Mengapa demikian? Keadaan itu terkait dengan fungsi air dalam pembesaran/pemanjangan sel dan jaringan. Kalau kita bandingankah dua tumbuhan dengan usia yang sama, namun yang satu mengalami kekurangan air dan yang lainnya memperoleh cukup air maka secara kuantitatif jumlah selnya mungkin tidak terlalu berbeda. Namun, kalau kita perhatikan ukuran selnya akan berbeda sehingga tumbuhan yang hidup pada keadaan cukup air akan memiliki ukuran sel yang lebih besar/panjang dari pada tumbuhan yang kekurangan air.
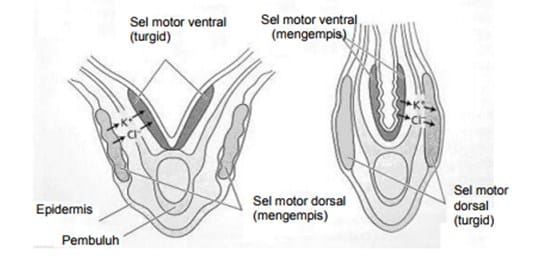
Proses pemanjangan sel tersebut disebabkan karena masuknya air ke dalam sel. Pernahkah Anda mengamati pergerakan tumbuhan? Pergerakan yang dimaksudkan bukan karena digoyang oleh angin, tetapi karena organ tumbuhan sendiri yang bergerak. Pergerakan yang dimaksud adalah seperti yang terjadi pada daun putri malu yang menutup ketika disentuh. Penutupan daun ini terjadi karena distribusi air keluar atau masuk jaringan pulvinus. Skema Gambar 1.1. berikut menjelaskan bagaimana gerakan daun itu terjadi. Ada dua kelompok sel yang bisa menyerap atau memompa air di bagian atas dan bawah dari pangkal daun. Apabila sel-sel pulvinus bagian atas mengakumulasi ion K+ dan Cldalam jumlah besar maka air dari sel sekelilingnya akan terserap masuk ke sel-sel pulvinus tersebut. Akibatnya sel-sel tersebut akan menggembung yang berakibat pada pembukaan daun. Keadaan sebaliknya terjadi apabila air masuk ke dalam sel-sel pulvinus
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Air Permukaan – Karakteristik, Kualitas, Debit, Pengolahan, Pengukuran, Contoh, Para Ahli
Struktur dan komposisi Air
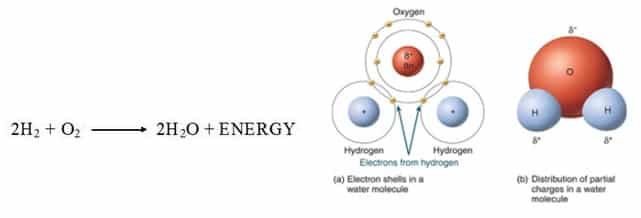
Air adalah molekul sederhana yang terdiri dari satu atom oksigen terikat pada dua atom hidrogen yang berbeda. Karena elektronegativitas lebih tinggi dari atom oksigen, ikatan tersebut adalah kovalen polar (ikatan polar).
Bagi setiap 1 molekul air, ada 2 atom hidrogen yang telah bergabung dengan 1 atom oksigen. Komposisi air atau kandungan air ini boleh diuraikan semula kepada bahan asas nya melalui proses elektrolisis. Elektrolisis adalah proses menguraikan elektrolit (dalam kes ini adalah air) kepada komponen asalnya, iaitu oksigen dan hidrogen.
Komposisi 1 molekul air yang terbentuk daripada gabungan 1 atom oksigen dan 2 atom hidrogen.
Dibutuhkan dua molekul gas hidrogen diatomik, dikombinasikan dengan satu molekul dari gas oksigen diatomik untuk menghasilkan dua molekul air. Dengan kata lain rasio hidrogen terhadap oksigen adalah 2:1, rasio hidrogen terhadap air adalah 1:1, dan rasio oksigen ke air adalah 1:2.
Baca Juga Artikel Yang Mungkin Berhubungan : √ Pengertian Dan Ciri Zat Padat, Gas, Cair Beserta Contohnya
Sifat-Sifat Air
|
Informasi dan sifat-sifat |
|
| Nama sistematis | air |
| Nama alternatif | aqua, dihidrogen monoksida, Hidrogen hidroksida |
| Rumus molekul | H2O |
| Massa molar | 18.0153 g/mol |
| Densitas dan fase | 0.998 g/cm³ (cariran pada 20 °C) 0.92 g/cm³ (padatan) |
| Titik lebur | 0 °C (273.15 K) (32 °F) |
| Titik didih | 100 °C (373.15 K) (212 °F) |
| Kalor jenis | 4184 J/(kg·K) (cairan pada 20 °C) |
- Air dalam fasa padat (es) lebih ringan dibandingkan fasa cairnya
- Air dapat melarutkan garam dan gas tetapi dapat dengan mudah terpisah sebagai uap murni.
- Air yang mempunyai viskositas yang rendah dan tidak lengket
- Air memiliki berat cukup untuk dapat dipindahkan oleh gaya gravitasi.
- Air bersifat tidak berwarna, tidak berasadan tidak berbau pada kondisi standar, yaitu pada tekanan 100 kPa (1 bar) and temperatur 273,15 K (0 °C).
- Air merupakan pelarut universal karena memiliki kemampuan untuk melarutkan banyak zat kimia lainnya.
- Air menempati ruang
- Air mempunyai berat
- Permukaan air yang tenang selalu datar
- Air mengalir ketempat yang lebih rendah
- air menekan ke segala arah
- Air meresap melalui celah kecil
- Air dapat berubah wujud
- air mengalir dari tempat yang tinggi ke tempat rendah
Baca Juga Artikel Yang Mungkin Berhubungan : Ekosistem Air Laut – Pengertian, Ciri, Jenis, Habitat, Komunitas, Masalah, Pembagian Daerah
Sifat Kimia Air
Kandungan Bahan Kimia dalam Air
Air mempunyai sifat melarutkan bahan kimia. Abel Wolman menyatakan bahwa air rumusnya adalah: H2O + X, dimana X adalah zat zat yang dihasilkan air buangan oleh aktivitas manusia selama beberapa tahun. dengan bertambahnya aktivitas manusia, maka factor X tsb dalam air akan bertambah dan menjadi masalah.
Faktor X merupakan zat zat kimia yang mudah larut dalam air dan dapat menimbulkan masalah sbb:
– Toksisitas
– Reaksi reaksi kimia yang menyebabkan :
- Pengendapan yang berlebihan
- Timbulnya busa yang menetap, yang sulit untuk dihilangkan
- Timbulnya respon fisiologis yang tidak diharapkan terhadap rasa atau pengaruh laxatif
- Perubahan dari perwujudan fisik air
Beberapa faktor kimia perairan yang berperan penting dalam ekosistem perairan antara lain adalah pH, gas terlarut, garam-garam an-organik, senyawa organik, BOD biasanya diukur dalam setiap kajian ekologis suatu sistem perairan menggenang. Cara sederhana yang memberikan perkiraan pengukuran maupun cara canggih untuk memperkirakan secara sangat teliti dengan menggunakan alat yang mahal, telah dikembangkan. Cara yang dipilih sangat tergantung pada sifat pekerjaan yang akan dilakukan.
- Salinitas
Salinitas adalah banyaknya zat terlarut. Zat padat terlarut meliputi garam-garam anorganik, senyawa-senyawa organik yang berasal dari organisme hidup, dan gas-gas terlarut (Nybakken, 1992). Ciri paling khas pada air laut yang diketahui oleh semua orang ialah rasanya yang asin. Ini disebabkan karena didalam air laut terlarut garam-garam yang paling utama adalah natrum klorida (NaCl) yang sering disebut garam dapur. Selain NaCl, di dalam air laut terdapat pula MgCl2, kalium, kalsium dan sebagainya. Salinitas adalah jumlah berat semua garam (dalam gram) yang terlarut dalam satu liter air, biasanya dinyatakan dengan satuan 0/00 (permil, gram per liter) (Nontji, 1986) Di perairan pantai karena terjadi pengenceran misalnya karena pengaruh aliran sungai salinitas bisa turun rendah. Sebaliknya di daerah dengan penguapan yang sangat kuat, salinitas bisa meningkat tinggi. Air payau adalah istilah umum yang digunakan untuk menyatakan air yang salinitasnya antara air tawar dan air laut. Perairan estuari atau daerah sekitar kuala dapat mempengaruhi struktur salinitas yang kompleks, karena selain merupakan pertemuan antara air tawar yang relatif ringan dan air laut yang lebih berat juga pengadukan air sangat menentukan (Nontji, 1986).
- Derajat keasaman (pH)
Nilai pH air yang normal adalah netral, yaitu antara pH 6 sampai pH 8 (Fardiaz, 1992). Air yang pH-nya kurang dari 7 bersifat asam, sedangkan yang pH-nya lebih dari 7 bersifat basa. Tanah yang bersifat asam akan mengakibatkan pelarutan dan ketersediaan logam berat yang berlebihan dalam tanah (Darmono, 1995). Perubahan pH yang sangat asam maupun basa akan mengganggu kelangsungan hidup organisme akuatik karena menyebabkan terganggunya metabolisme dan respirasi. Derajat keasaman adalah suatu ukuran dari konsentrasi ion hidrogen dan menunjukkan suasana air tersebut apakah bereaksi asam atau basa. Kisaran pH air yang maksimal untuk produksi ikan adalah 6,5 sampai 9 (Boyd,1981). Fluktuasi pH sangat dipengaruhi oleh proses respirasi, karena gas karbondioksida yang dihasilkannya. Semakin banyak karbondioksida yang dihasilkan dari proses respirasi, maka pH akan semakin rendah. Namun sebaliknya jika aktivitas fotosintesis semakin tinggi maka akan menyebabkan pH semakin tinggi (Kordi, 2000). Pengukuran derajat keasaman dilakukan dengan variasi waktu siang dan malam. Langkah tersebut didasarkan pada perbedaan aktivitas biota pada siang dan malam hari. Pengambilan lokasi bisa dilakukan dengan berbagai cara, seperti transek pada kedalaman yang berbeda dan tempat-tempat yang memiliki potensi menimbulkan pencemaran (sumber pencemaran terpusat).
- Oksigen Terlarut (DO)
Pemasukan air tawar dan air laut yang teratur ke badan estuari dan ditambah lagi dengan kedangkalan, turbulensi dan percampuran oleh angin, biasanya suplai oksigen cukup banyak dalam kolom air. Kelarutan oksigen dalam air menurun jika suhu dan salinitas meningkat. Jumlah oksigen dalam air akan bervariasi jika parameter suhu dan salinitas bervariasi (Green, 1968). Oksigen terlarut merupakan kebutuhan dasar untuk kehidupan tanaman dan hewan di dalam air. Kehidupan makhluk hidup di dalam air tersebut tergantung dari kemampuan air untuk mempertahankan konsentrasi oksigen minimal yang dibutuhkan untuk kehidupannya (Fardiaz, 1992). Oksigen terlarut dapat berasal dari proses fotosintesis tanaman air, dimana jumlahnya tidak tetap tergantung dari jumlah tanamannya, dan dari atmosfer (udara) yang masuk ke dalam air dengan kecepatan terbatas (Fardiaz, 1992). Oksigen terlarut dalam laut dimanfaatkan oleh organisme perairan untuk respirasi dan penguraian zat-zat organik oleh mikroorganisme. Konsentrasi oksigen terlarut dalam keadaan jenuh bervariasi tergantung dari suhu dan tekanan atmosfer (Fardiaz, 1992).
Oksigen merupakan faktor pembatas dalam penentuan kehadiran makhluk hidup di dalam air. kepekatan oksigen terlarut bergantung kepada:
- Suhu.
- Kehadiran tanaman fotosintesis.
- Tingkat penetrasi cahaya yang bergantung kepada kedalaman dan kekeruhan air.
- Tingkat kederasan aliran air.
- Jumlah bahan organik yang diuraikan dalam air seperti sampah, ganggang mati atau limbah industri (Sastrawijaya, 2001).
Pengukuran oksigen terlarut bisa dilakukan dengan metode sensor oskigen elektronik dan titrasi Winkler. Hasil pengukuran berada pada satuan persen (%) dan mg/L. Pengukuran dilakukan pada variasi siang dan malam serta pada musim yang berbeda. Penentuan siang malam menentukan disebabkan karena adanya aktivitas respirasi dan fotosintesis pada siang hari, sedangkan musim untuk mengetahui pengaruh perbedaan aktivitas makhluk hidup tergantung musim pada kadar oksigen terlarut.
Anasliss Oksigen Terlarut (DO)
Oksigen terlarut dapat dianalisis atau ditentukan dengan 2 macam cara, yaitu :
- Metoda titrasi dengan cara WINKLER
- Metoda elektrokimia
1. Metoda titrasi dengan cara WINKLER
Metoda titrasi dengan cara WINKLER secara umum banyak digunakan untuk menentukan kadar oksigen terlarut. Prinsipnya dengan menggunakan titrasi iodometri. Sampel yang akan dianalisis terlebih dahulu ditambahkan larutan MnCl2 den Na0H – KI, sehingga akan terjadi endapan Mn02. Dengan menambahkan H2SO4 atan HCl maka endapan yang terjadi akan larut kembali dan juga akan membebaskan molekul iodium (I2) yang ekivalen dengan oksigen terlarut. Iodium yang dibebaskan ini selanjutnya dititrasi dengan larutan standar natrium tiosulfat (Na2S203) dan menggunakan indikator larutan amilum (kanji).
Reaksi kimia yang terjadi dapat dirumuskan sebagai berikut :
- MnCI2 + NaOH→ Mn(OH)2 + 2 NaCI
- 2 Mn(OH)2 + O2 →2 MnO2 + 2 H20
- MnO2 + 2 KI + 2 H2O →Mn(OH)2 + I2 + 2 KOH
- I2 + 2 Na2S2C3→ Na2S4O6 + 2 NaI
2. Metoda elektrokimia
Cara penentuan oksigen terlarut dengan metoda elektrokimia adalah cara langsung untuk menentukan oksigen terlarut dengan alat DO meter. Prinsip kerjanya adalah menggunakan probe oksigen yang terdiri dari katoda dan anoda yang direndam dalarn larutan elektrolit. Pada alat DO meter, probe ini biasanya menggunakan katoda perak (Ag) dan anoda timbal (Pb). Secara keseluruhan, elektroda ini dilapisi dengan membran plastik yang bersifat semi permeable terhadap oksigen. Reaksi kimia yang akan terjadi adalah :
- Katoda : O2 + 2 H2O + 4- →4 HO-
- Anoda : Pb + 2 HO- →PbO + H20 + 2e-
Aliran reaksi yang terjadi tersebut tergantung dari aliran oksigen pada katoda. Difusi oksigen dari sampel ke elektroda berbanding lurus terhadap konsentrasi oksigen terlarut. Penentuan oksigen terlarut (DO) dengan cara titrasi berdasarkan metoda WINKLER lebih analitis apabila dibandingkan dengan cara alat DO meter. Hal yang perlu diperhatikan dalam titrasi iodometri ialah penentuan titik akhir titrasinya, standarisasi larutan tiosulfat dan pembuatan larutan standar kaliumbikromat yang tepat. Dengan mengikuti prosedur penimbangan kaliumbikromat dan standarisasi tiosulfat secara analitis, akan diperoleh hasil penentuan oksigen terlarut yang lebih akurat. Sedangkan penentuan oksigen terlarut dengan cara DO meter, harus diperhatikan suhu dan salinitas sampel yang akan diperiksa. Peranan suhu dan salinitas ini sangat vital terhadap akurasi penentuan oksigen terlarut dengan cara DO meter. Disamping itu, sebagaimana lazimnya alat yang digital, peranan kalibrasi alat sangat menentukan akurasinya hasil penentuan. Berdasarkan pengalaman di lapangan,penentuan oksigen terlarut dengan cara titrasi lebih dianjurkan untuk mendapatkan hasil yang lebih akurat. Alat DO meter masih dianjurkan jika sifat penentuannya hanya bersifat kisaran.
Praktek Pengukuran Kadar O2 terlarut (DO):
- Pengambilan sampel air dilakukan dengan menggunakan metode Mikro Winkler. Botol sampel ditenggelamkan perlahan lahan ke dalam air, setelah penuh ditutup dalam posisi masih dalam air. Ke dalam botol sampel ditambahkan 1 ml MnSO4 (22 tetes) diikuti dengan 1 ml larutan KOH-KI. Kemudian botol sampel ditutup kembali, campuran diaduk dengan cara dibolak balikan beberapa kali, dibiarkan sebentar hingga terbentuk endapan berwarna coklat, dengan menggunakan pipet ditambahkan 1 ml larutan H2SO4 pekat melalui didnding botol. Endapan akan larut dan terbentuk cairan bening kekuningan. Botol disumbat dan dibolak-balikan, dibiarkan kira-kira 10 menit. Bila titrasi tidak dapat dilakukan dilapangan botol dapat dibungkus dengan kain basah dan dibawa ke laboratorium. Air sampel diambil 100 ml kemudian dititrasi dengan Natrium thiosulfat 0,025 N sampai warna kuning muda, kemudian ditambahkan 5 tetes amilum hingga larutan berwarna biru. Titrasi dilanjutkan kembali sampai warna biru tepat hilang.
Kadar Oxygen terlarut = 1000 : air sampel x ml Na2 S2O3 X N titran X 8 ppm
8 ppm : bobot setara oksigen Atau dengan cara -
Mengambil sampel air yang akan diukur sebanyak 40 cc dengan erlenmeyer, tambahkan 8 tetes MnSO4 digoyang pelan-pelan, tambahkan larutan KOH-KI 8 tetes, tambahkan 0,5 cc larutan H2SO4 pekat pelan-pelan melalui dinding erlenmeyer, digoyang-goyang hingga endapan coklat hilang dan warna menjadi kuning. Air sampel ditambah hingga volume menjadi 50 cc dan diamkan kira-kira 10 – 15 menit. Sampel kemudian dititrasi dengan larutan Na2S2O3 0,025 N hingga warna mwenjadi kuning jerami (kuning pucat). Teteskan Amilum sebanyak 8 tetes, titrasi dilanjutkan hingga warna biru tepat hilang. Catat volume titran yang digunakan.
DO = Jumlah skala X 0,05 ppm (untuk disposible spuit 100 skala)
DO = Jumlah skala X 0,04 ppm (untuk disposible spuit 80 skala)
– Pengukuran oksigen terlarut (DO) juga dilakukan dengan menggunakan DO meter
yang digunakan sebagai pembanding
4. Alkalinitas
Alkalinitas adalah gambaran kapasitas air untuk menetralkan asam yang dikenal dengan sebutan Acid Neutralizing Capacity (ANC) atau kuantitas anion di dalam air yang dapat menetralkan kation hidrogen. Selain itu alkalinitas juga berfungsi sebagai penyangga PH. Penyusun alkalinitas yang paling utama di perairan adalah anion bikarbonat (HCO3-), karbonat (CO3- ) dan hidroksida (OH-).
Perairan dengan nilai alkalinitas tinggi lebih produktif daripada perairan dengan nilai alkalinitas rendah. Lebih produktifnya perairan ini sebenarnya tidak berkaitan secara langsung dengan nilai alkainitas akan tetapi berkaitan dengan keberadaan fosfor dan elemen esensial lainnya yang meningkat kadarnya dengan meningkatnya alkalinitas. Nilai alkalinitas yang baik berkisar antara 30-500 mg/L CaCO3.
5. Karbondioksida (CO2) bebas
Karbondioksida merupakan produk dari respirasi yang dilakukan oleh tanaman maupun hewan. Ketersediaan karbondioksida adalah sumber utama untuk fotosintesis, dan pada banyak cara menunjukkan hubungan keterbalikan dengan oksigen. Meskipun suhu merupakan faktor utama dalam regulasi konsentrasi oksigen dan karbondioksida, tetapi hal ini juga tergantung pada fotosintesis tanaman, respirasi dari semua organisme, aerasi air, keberadaan gas–gas lainnya dan oksidasi kimia yang mungkin terjadi (Goldman dan Horne, 1983).
Ketersediaan karbondioksida terlarut di air dapat bersumber dari air tanah, dekomposisi zat organik, respirasi organisme air, senyawa kimia dalam air maupun dari udara namun dalam jumlah yang sangat sedikit (Subarijanti, 1990). Tumbuhan akuatik, misalnya alga, lebih menyukai karbondioksida sebagai sumber karbon dibandingkan dengan bikarbonat dan karbonat. Bikarbonat sebenarnya dapat berperan sebagai sumber karbon. Namun di dalam kloroplas bikarbonat harus dikonversi terlebih dahulu menjadi karbondioksida dengan bantuan enzim karbonik anhidrase (Boney, 1989 dalam Effendi, 2003).
Pengukuran CO2 Bebas:
Sampel diambil sebanyak 20 cc ke dalam tabung pengukuran CO2. Teteskan indikator phenolphtalein sebanyak 3 tetes apabila berwarna merah berarti tidak ada CO2 bebas dan pekerjaan dihentikan. Apabila air sampel tidak berubah warna titrasi dilanjutkan dengan larutan NaOH 0,02 N hingga timbul warna merah muda, catat volume titran yang digunakan.
Perhitungan kandungan CO2 beba
CO2 = Jumlah skala X 0,5 ppm (untuk disposible spuit 100 skala)
CO2 = Jumlah skala X 0,4 ppm (untuk disposible spuit 80 skala)
Atau : (pengukuran karbon dioksida bebas dalam jumlah besar)
100 cc air sampel dimasukan dalam labu erlenmeyer ditambahkan 3 tetes indikator pp dan dititrasi dengan larutan NaOH 0,1 N sampai warna larutan tepat menjadi warna merah muda, catat volume rtitran yang digunakan.
Konsentrasi CO2 bebas : 1000 : cc sampel x cc NaOH x N NaOH x 44 ppm
6. Nitrat (N-NO3)
Nitrogen selalu tersedia di ekosistem perairan dan melimpah dalam bentuk gas. Nitrogen hadir dalam bentuk kombinasi dari amonia, nitrat, nitrit, urea, dan senyawa organik terlarut dalam jumlah yang sedikit. Dari seluruh kombinasi tersebut, nitrat merupakan yang paling penting. Sel hidup mengandung sekitar 5% total nitrogen dari berat keringnya. Ketersediaan dari berbagai bentuk nitrogen tersebut dipengaruhi oleh varietas, kelimpahan dan nutrisi dari hewan maupun tanaman akuatik. Nitrogen sering hadir dalam jumlah yang dapat menjadi faktor pembatas bagi pertumbuhan tanaman. Kondisi ini umumnya terjadi pada daerah beriklim hangat dan daerah dimana ketersediaan pospor dan silikon relatif tinggi karena erosi alami dan pencemaran (Goldman dan Horne, 1983). Nitrat adalah sumber nitrogen dalam air laut maupun air tawar. Bentuk kombinasi lain dari elemen ini bisa tersedia dalam bentuk amonia, nitrit dan komponen organik. Kombinasi elemen ini sering dimanfaatkan oleh fitoplankton terutama kalau unsur nitrat terbatas. Nitrogen terlarut juga bisa dimanfaatkan oleh jenis blue-green algae dengan cara fiksasi nitrogen (Herawati,1989).
7. Ortofosfat
Fosfor tidak dibutuhkan dalam jumlah besar untuk pertumbuhan tanaman, tidak seperti karbon, oksigen, hidrogen dan nitrogen. Tapi fosfor merupakan salah satu elemen pembatas baik di tanah maupun di perairan tawar, karena fosfor sangat langka dan terkandung dalam batuan dengan jumlah yang sedikit dan fosfor tidak memiliki bentuk gas dalam siklusnya sehingga tidak dapat difiksasi seperti nitrogen, selain itu fosfor terikat secara reaktif pada berbagai jenis tanah (Goldman dan Horne, 1983).
Secara umum ada tiga bentuk fosfor di ekosistem akuatik, yaitu fosfat terlarut, fosfor total terlarut dan fosfor partikulat. Fosfat di danau terdapat baik dalam organik maupun anorganik. Bentuk anorganik fosfat sebagian besar adalah ortofosfat (PO4-) dan sebagian lagi bentuk monofosfat (HPO4-) dan dihydrogen fosfat (H2PO4-) (Goldman dan Horne, 1983). Input utama fosfor ke danau berasal dari aliran sungai dan pengendapan. Air hujan juga merupakan sumber fosfor namun hanya sedikit mengandung fosfor dari pada nitrogen. Sebagian besar fosfor terbawa ke danau yang tidak terpolusi sebagai partikel organik dan anorganik. Hampir setengah dari fosfor yang tekandung dalam limbah rumah tangga berasal dari detergen (Goldman dan Horne, 1983).
8. Kebutuhan Oksigen Biologi (BOD)
Kebutuhan oksigen biologi (BOD) didefinisikan sebagai banyaknya oksigen yang diperlukan oleh organisme pada saat pemecahan bahan organik, pada kondisi aerobik. Pemecahan bahan organik diartikan bahwa bahan organik ini digunakan oleh organisme sebagai bahan makanan dan energinya diperoleh dari proses oksidasi (PESCOD,1973).
Parameter BOD, secara umum banyak dipakai untuk menentukan tingkat pencemaran air buangan. Penentuan BOD sangat penting untuk menelusuri aliran pencemaran dari tingkat hulu ke muara. Sesungguhnya penentuan BOD merupakan suatu prosedur bioassay yang menyangkut pengukuran banyaknya oksigen yang digunakan oleh organisme selama organisme tersebut menguraikan bahan organik yang ada dalam suatu perairan, pada kondisi yang harnpir sama dengan kondisi yang ada di alam. Selama pemeriksaan BOD, contoh yang diperiksa harus bebas dari udara luar untuk rnencegah kontaminasi dari oksigen yang ada di udara bebas.
Konsentrasi air buangan/sampel tersebut juga harus berada pada suatu tingkat pencemaran tertentu, hal ini untuk menjaga supaya oksigen terlarut selalu ada selama pemeriksaan. Hal ini penting diperhatikan mengingat kelarutan oksigen dalam air terbatas dan hanya berkisar ± 9 ppm pads suhu 20°C Penguraian bahan organik secara biologis di alam, melibatkan bermacam-macam organisme dan menyangkut reaksi oksidasi dengan hasil akhir karbon dioksida (CO2) dan air (H2O). Pemeriksaan BOD tersebut dianggap sebagai suatu prosedur oksidasi dimana organisme hidup bertindak sebagai medium untuk menguraikan bahan organik menjadi CO2 dan H2O. Reaksi oksidasi selama pemeriksaan BOD merupakan hasil dari aktifitas biologis dengan kecepatan reaksi yang berlangsung sangat dipengaruhi oleh jumlah populasi dan suhu.
Karenanya selama pemeriksaan BOD, suhu harus diusahakan konstan pada 20°C yang merupakan suhu yang umum di alam. Secara teoritis, waktu yang diperlukan untuk proses oksidasi yang sempurna sehingga bahan organik terurai menjadi CO2 dan H2O adalah tidak terbatas. Dalam prakteknya dilaboratoriurn, biasanya berlangsung selama 5 hari dengan anggapan bahwa selama waktu itu persentase reaksi cukup besar dari total BOD. Nilai BOD 5 hari merupakan bagian dari total BOD dan nilai BOD 5 hari merupakan 70 – 80% dari nilai BOD total (SAWYER & MC CARTY, 1978). Penentuan waktu inkubasi adalah 5 hari, dapat mengurangi kemungkinan hasil oksidasi ammonia (NH3) yang cukup tinggi. Sebagaimana diketahui bahwa, ammonia sebagai hasil sampingan ini dapat dioksidasi menjadi nitrit dan nitrat, sehingga dapat mempengaruhi hasil penentuan BOD.
Reaksi kimia yang dapat terjadi adalah :
- 2NH3+3 O2→ 2NO2_ + 2 H ++ + 2 H2O
- 2NO2 + O2 →2 NO3-
Oksidasi nitrogen anorganik ini memerlukan oksigen terlarut, sehingga perlu diperhitungkan. Dalam praktek untuk penentuan BOD yang berdasarkan pada pemeriksaan oksigen terlarut (DO), biasanya dilakukan secara langsung atau dengan cara pengenceran. Prosedur secara umum adalah menyesuaikan sampel pada suhu 20°C dan mengalirkan oksigen atau udara kedalam air untuk memperbesar kadar oksigen terlarut dan mengurangi gas yang terlarut, sehingga sampel mendekati kejenuhan oksigen terlarut. Dengan cara pengenceran pengukuran BOD didasarkan atas kecepatan degradasi biokimia bahan organik yang berbanding langsung dengan banyaknya zat yang tidak teroksidasi pada saat tertentu. Kecepatan dimana oksigen yang digunakan dalam pengenceran sampel berbanding lurus dengan persentase sampel yang ada dalam pengenceran dengan anggaapan faktor lainnya adalah konstan. Sebagai contoh adalah 10 % pengenceran akan menggunakan sepersepuluh dari kecepatan penggunaan sampel 100% (SAWYER & MC CARTY, 1978).
Dalam hal dilakukan pengenceran, kualitas aimya perlu diperhatikan dan secara umum yang dipakai aquades yangtelah mengalami demineralisasi. Untuk analisis air laut, pengencer yang digunakan adalah standard sea water (SSW). Oerajat keasaman (pH) air pengencer biasanya berkisar antara 6,5 – 8,5 dan untuk menjaga agar pH-nya konstan bisa digunakan larutan penyangga (buffer) fosfat. Untuk menentukan BOD, terlebih dahulu diukur DO nya (DO 0 hari), sementara sampel yang lainnya diinkubasi selama 5 hari pada suhu 20°C, selanjutnya setelah 5 hari diukur DO nya (DO 5 hari). Kadar BOD ditentukan dengan rumus :
5 X [ kadar { DO(0 hari) – DO (5 hari) }] ppm
Selama penentuan oksigen terlarut, baik untuk DO maupun BOD, diusahakan seminimal mungkin larutan sampai yang akan diperiksa tidak berkontak dengan udara bebas. Khusus untuk penentuan BOD, sebaiknya digunakan botol sampel BOD dengan volume 250 ml dan semua isinya dititrasi secara langsung.
Perhitungan kadar DO nya :
- DO,ml/L = B/B -2 x 5,6 x 10 x N x V
- B = volume botol sampel BOD = 250 ml
- B – 2 = volume air dalam botol sampel setelah ditambah 1 ml larutan MnCl2 dan 1 ml NaOH – KI.
- 5,6 = konstanta yang sama dengan ml oksigen ~ 1 mgrek tiosulfat
- 10 = volume K2Cr2O7 0,01 N yang ditambahkan
- N = normalitas tiosulfat
- V = volume tiosulfat yang dibutuhkan untuk titrasi.
Nitrat dan fosfat dalam tubuh air dapat berkontribusi terhadap tingkat BOD yang tinggi. Yang menyebabkan kehidupan tanaman dan ganggang untuk tumbuh dengan cepat. Jika tanaman tumbuh dengan cepat, mereka juga mati dengan cepat. Ini berkontribusi pada limbah organik di dalam air, yang kemudian diurai oleh bakteri. Hal ini menyebabkan tingkat BOD yang tinggi. Para suhu air juga dapat berkontribusi untuk tingkat BOD yang tinggi. Seiring dengan peningkatan suhu air, laju fotosintesis oleh ganggang dan tanaman lainnya di dalam air juga meningkat. Ketika ini terjadi, tanaman tumbuh lebih cepat dan juga mati lebih cepat. Ketika tanaman mati, mereka jatuh ke bawah di mana mereka terurai oleh bakteri. Bakteri yang membutuhkan oksigen untuk proses ini sehingga Direksi tinggi di lokasi ini. Oleh karena itu, peningkatan suhu air akan mempercepat dekomposisi bakteri dan menghasilkan tingkat BOD lebih tinggi.
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Cairan Intraseluler Dan Ekstraseluler Beserta Perbedaannya
Fungsi Air Sebagai Pelarut
Air mampu melarutkan lebih banyak bahan daripada zat cair umum lainnya. Hal itu sebagian disebabkan karena air memiliki tetapan dielektrik yang termasuk paling tinggi, yaitu suatu ukuran kemampuan untuk menebalkan tarik-menarik antar muatan listrik. Karena sifatnya itu, air menjadi pelarut yang sangat kuat bagi elektrolit dan molekul polar seperti gula. Sisi positif molekul air ditarik oleh ion atau permukaan molekul polar yang negatif, dan sisi negatifnya oleh ion atau permukaan positif. Jadi, molekul air membentuk suatu “sangkar” mengelilingi ion atau molekul polar, sehingga ion dan molekul tersebut sering tak dapat bergabung dengan yang lain dan tidak mengkristal membentuk endapan.
Pentingnya air sebagai pelarut dalam organisme hidup tampak amat jelas dalam proses osmosis. Bergantung pada bahan terlarut yang ada di dalam air sel. Kita juga akan berurusan dengan pergerakan berbagai bahan terlarut dengan cara difusi, dan aliran massa dalam tumbuhan. Molekul air secara aktif terlibat dalam reaksi kimia yang menjadi dasar kehidupan. Misalnya, bersama dengan molekul karbondioksida, air merupakan bahan mentah bagi fotosintesis. Hanya sedikit proses metabolism yang mampu berjalan tanpa menggunakan atau menghasilkan molekul air. Walaupun demikian air relatif lembam secara kimia. Sebaliknya, air jauh lebih penting sebagai lingkungan bagi berbagai reaksi kimia daripada sebagai pereaksi atau hasil reaksi.
Fungsi air sebagai pelarut adalah sebagai berikut antara lain :
- Larutan
larutan dalam hal ini merupakan sebuah campuran dari dua atau lebih zat. Bahan yang memiliki sifat melarutkan disebut sebagai zat pelarut. Yang disisi lain, zat yang dilarutkan disebut dengan zat terlarut. Misalnya satu sendok makan gula dimasukkan ke dalam sebuah gelas yang terisi air, maka pada gula tersebut akan terlarut di dalam air. Gula dan air akan menjadi campuran seragam “homogen”, gula sebagai zat terlarut, sedangkan air sebagai zat pelarut.
Contoh lain larutan ialah kristal dapur yang dapat terlarut pula dalam air. Garam dapur merupakan kristal senyawa ionik natrium klorida “NaCI”, Oksigen dari molekul air bermuatan negatif. Okisgen akan berikatan dengan kation natrium. Begitupun dengan anion klorida akan menarik hidrogen yang bermuatan positif dari molekul air. Air akan menembus kristal garam dan akhirnya akan melarutkan seluruh ion. Sifat air akan memisahkan natrium dari klorida sehingga dua zat terlarut “natrium dan klorida” akan terlarut secara homogen dalam air.
- Koloid
Dalam hal ini koloid ialah dua zat atau lebih yang ketercampurannya berada diantara homogen dan heterogen. Hal ini disebabkan perbedaan ukuran partikel antara zat terlarut dan zat pelarut. Partikel-partikel koloid tidak dapat dilihat pada mikroskop biasa, melainkan dengan mikroskop ultra, contoh koloid ialah saus tomat mayonnaise dan penggumpalan susu.
- Suspensi
Suspensi merupakan dua zat yang tercampur tapi bersifat heterogen, terjadi pemisahan fase antara pelarut dan zat terlarut. Hal ini juga disebabkan oleh ukuran partikel pada zat terlarut cukup besar dibandingkan zat pelatut, sehingga zat terlarut mengendap, contohnya pati dalam air dingin.
Dari zaman duhulu, ahli kimia mencoba menemukan pelarut universal yang dapat mampu melarutkan segala macam zat, akan tetapi tidak ada yang menemukan zat pelarut yang lebih baik dari air. Melalui polaritas molekul air, maka air dapat menjadi pelarut yang serbaguna pada suatu zat tertentu berdasarkan atas ukuran partikel dan luas relatif permukaan.
Baca Juga Artikel Yang Mungkin Berhubungan : Penjelasan 4 Perangkat Fotosintesis Dalam Biologi
Pengukuran Air Laju Transpirasi
PENGUKURAN LAJU TRANSPIRASI
- Metode Lisimeter atau Metode Gravimetric.
Metode lisimeter ditemukan dua abad yang lalu oleh Stephen Hales. Ia mempersiapkan tanaman dalam pot. Pot dan tanahnya ditutup rapat agar air tidak hilang, kecuali dari tajuknya yang bertranspirasi. Kemudian tanaman dalam pot itu ditimbang pada selang waktu tertentu, dan arena jumlah air yang digunakan
untuk pertumbuhan tanaman kurang dari 1% dari jumlah air yang ditranspirasikan, maka sebenarnya semua perubahan bobot dapat dianggap berasal dari transpirasi. Ini dinamakan metode lisimeter. Haks dan peneliti lainnya sudah banyak mengembangkan metode ini. Lisimeter miliknya di kebun Greenville berupa beberapa bejana yang besar diisi penuh dengan tanah dan dikuburkan, sehingga permukaan atasnya sama tinggi
dengan permukaan lapangan.
Bejana tersebut diletakkan diatas sebuah bantalan karet besar yang diletakkan di dasarnya dan diisi air dan zat antibeku yang dihubungkan dengan pipa yang tegak keatas permukaan tanah. Tinggi cairan dalam pipa menunjukkan ukuran bobot lisimeter, maka permukaannya berubah-ubah sejalan dengan perubahan kandungan air dalam tanah di lisimeter dan dalam tanaman yang sedang tumbuh, Walaupun bobotnya kecil saja dibandingkan dengan bobot tanah. Jumlah air tanah ditentukan oleh air irigasi
an curah hujan, dikurangi evapotranspirasi, yaitu gabungan antara penguapan dari tanah dan transpirasi dari tumbuhan. Penguapan dari tanah dapat diduga dari berbagai macam cara.
- Metode Pertukaran Gas atau Metode Kuvet.
Dalam metode ini, transpirasi dihitung dengan cara mengukur uap air di atmosfer yang tertutup yang mengelilingi daun. Sehelai daun dikurung dalam sebuah kuvet bening. Misalnya kelembapan, suhu, dan volume gas yang masuk dan keluar kuvet diukur. Informasi yang diperoleh bergantung pada parameter yang diukur. Laju transpirasi, daya hantar stomata, laju fotosintesis, dan konsentrasi CO2 dalam daun dapat diukur.
Metode kuvet menjadi penting dalam beberapa tahun terakhir ini karena peralatan telah diperbaiki, dan alat pengolah mikro mudah diperoleh untuk menghitung secara cepat parameter fisiologis dari hasil yang ditangkap oleh sensor.
Parameter sudah digunakan secara luas untuk mengukur transpirasi di lapangan dan di laboratorium. Ruang kecil (kuvet) hanya berdiameter 1-2 cm, dijepitkan sebentar pada permukaan daun (biasanya pada permukaan bawah yang memiliki stomata paling banyak), dan kelembapan di dalam ruang tersebut dipantau. Baru-baru ini, parometer mapan tersedia di pasaran. Udara dialirkan melalui kolom pengering dan masuk ke kuvet dengan laju yang benar-benar cukup untuk mempertahankan kelembapan dalam kuvet tersebut seperti keadaan semula. Sebuah alat pengolah mikro menghitung transpirasi dari kelembapan mutlak (kelembapan nisbi dan suhu udara), serta laju masuknya udara kering untuk mempertahankan kelembapan tetap konstan. Data yang dihasilkan memang dapat dipercaya, tapi alat tersebut mahal.
- Metode Aliran Batang.
Apabila jumlah air yang mengalir melalui batang dapat diukur, maka besarnya transpirasi dapat diperkirakan secara baik, terutama pada tumbuhan herba yang pendek. Pada tahun1932, B. Huber mengembangkan teknik dengan memberikan denyutan bahang pada suatu titik pada batang, dan kemudian suhunya diukur pada titik lain di atasnya. Waktu yang dibutuhkan oleh suhu yang ditinggikan untuk mencapai titik di atas tempat bahang diberikan menunjukkan kecepatan aliran cairan. Dengan mengetahui diameter batang dan konstanta lainnya, perkiraan terhadap besarnya transpirasi dapat dilakukan dan dibandingkan dengan hasil pengukuran dengan lisimeter atau teknik kuvet.
Ada teknik lain yang lebih langsung mengukur neraca bahang. Cermak
dkk (1976), misalnya mengembangkan teknik dengan memberikan bahang ke sekeliling batang pohon, dan termokopel dipasang pada alat pemanas dan di bagian bawah tersebut. Pemanas dan termokopel disekat secara rapat (misalnya, dengan busa putih). Bahang masuk secara otomatis dan terus menerus diatur, shingga selisih suhu antara bagian yang dipanasi dan bagian yang tidak dipanasi tetap. Bila aliran batang berubah, maka masukan bahang yang dibutuhkan juga berubah, dan dicatat aliran listrik yang diperlukan untuk mempertahankan agar gradient suhu tetap konstan. Dengan mengetahui bahang, jenis air dan jumlah bahang yang diberikan, persamaan yang sesuai dapat digunakan untuk menghitung laju aliran cairan. Alat pencatat data digital dapat digunakan untuk mencatat datanya, shingga diperoleh hasil transpirasi yang bersinambungan. Persamaan yang dipakai sangat menentukan agar metode ini tidak perlu dikalibrasi, dan waktu untuk mengamati hasilnya pun sekejap saja.
Tapi, peralatan elektronika yang diperlukan tidak sederhana dan harus disediakan sendiri. Dengan sedikit modifikasi untuk tumbuhan herba, Baker dan van bavel (1987) membuat sebuah alat yang sangat tahan panas (kertas Inconel 0,25 mm pada Kapton 0,05 mm di cat) dibungkuskan di sekeliling batang, dan termokopel ditempelkan pada batang di bawah dan di atas alat pemanas. Masukan bahang dipertahankan konstan, dan aliran bahang yang keluar dari sistem dihitung, untuk suhu gradient suhu yang terukur, sehingga laju aliran massa air dalam batang dapat langsung dihitung. Batang tersebut tidak terluka atau ditusuk, sehingga kalibrasi tidak diperlukan. Pengukuran lain dilakukan bersamaan dengan metode ini. Metode lisimeter dan metode kuvet memberikan hasil yang hampir sama (kurang dari 10% perbedaannya).
PROSES PLASMOLISIS
Plasmolisis adalah peristiwa terlepasnya protoplasma dari dinding sel karena sel berada dalam larutan hipertonik. Plasmolisis dapat memberikan gambaran untuk menentukan besarnya nilai osmosis sebuah sel. Jika sel tumbuhan ditempatkan dalam larutan yang hipertonik terhadap cairan selnya, maka air akan keluar dari sel tersebut sehingga plasma akan menyusut. Bila hal ini berlangsung terus menerus, maka plasma akan terlepas dari dinding sel. Hal inilah yang disebut plasmolisis.
Plasmolisis merupakan proses yang secara nyata menunjukkan bahwa pada sel, sebagai unit terkecil kehidupan, terjadi sirkulasi keluar masuk suatu zat. Adanya sirkulasi ini menjelaskan bahwa sel dinamis dengan lingkungannya. Jika memerlukan materi dari luar maka sel harus mengambil materi itu dengan segala cara, misalnya dengan mengatur tekanan agar terjadi perbedaan tekanan sehingga materi dari luar bisa masuk.
Plasmolisis merupakan dampak dari peristiwa osmosis. Jika sel tumbuhan diletakkan pada larutan hipertonik, sel tumbuhan akan kehilangan air dan tekanan turgor, yang menyebabkan sel tumbuhan lemah. Tumbuhan dengan kondisi sel seperti ini disebut layu. Kehilangan air lebih banyak lagi menyebabkan terjadinya plasmolisis, dimana tekanan harus berkurang sampai di suatu titik dimana sitoplasma mengerut dan menjauhi dinding sel, sehingga dapat terjadi cytorhysis. Contohnya dinding sel.