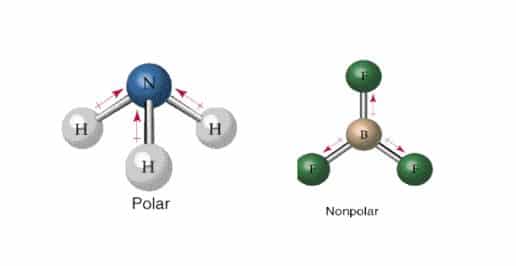
Senyawa Polar Dan Non Polar – Pengertian, Ciri, Kovalen, Perbedaan, Sifat, Titik Didih, Contoh : Dalam hal ini untuk dapat membedakan kedua senyawa berikut ini yakni senyawa polar dan non polar yang dapat ditunjukan dari beberapa sisi yang diantaranya dari ciri senyawa, distribusi elektronnya dan ukuran kuantitatif titik didih.
Senyawa Polar Dan Non Polar
Dalam hal ini untuk dapat membedakan kedua senyawa berikut ini yakni senyawa polar dan non polar yang dapat ditunjukan dari beberapa sisi yang diantaranya dari ciri senyawa, distribusi elektronnya dan ukuran kuantitatif titik didih. Nah untuk lebih jelasnya silahkan anda menginyak uraian berikut ini semiga dengan memberikan ulasan ini dapat menambah pengatahuan anda.
Baca Juga Artikel Yang Mungkin Berhubungan : 101 Pengertian, Fungsi Dan Macam-Macam Enzim Secara Lengkap
Senyawa Polar
Senyawa yang terbentuk akibat adanya suatu ikatan antar elektron pada unsur-unsurnya. Hal ini terjadi karena unsur yang berikatan tersebut mempunyai nilai keelektronegatifitas yang berbeda.
Ciri – Ciri Senyawa Polar
Ada beberapa ciri-ciri senyawa polar yang diantaranya yaitu:
- Dapat larut dalam air dan pelarut polar lain.
- Memiliki kutub + dan kutub – akibat tidak meratanya distribusi elektron.
Memiliki pasangan elektron bebas “apabila bentuk molekul diketahui” atau memiliki perbedaan keelektronegatifan.
Contoh Senyawa Polar :
- Alkhol, HCI, PC13, H2O, N2O5.
- H2O, HCL, HF, HI dan HBr
Senyawa Non Polar
Senyawa yang terbentuk akibat adanya suatu ikatan antar elektron pada unsur-unsur yang membentuknya. Hal ini terjadi karena unsur yang berikatan mempunyai nilai elektronegatifitas yang sama/hampir sama.
Ciri-Ciri Senyawa Non Polar
- Tidak larut dalam air dan pelarut polar lain.
- Tidak memiliki kutub + dan kutub – akibat meratanya distribusi elektron.
Tidak memiliki pasangan eletron bebas “bila bentuk molekul diketahui” atau keelektronegarifannnya sama.
Contoh Senyawa Non Polar :
- C12, PC15, H2, N2.
- O2, CO2,CH4 dan Cl2
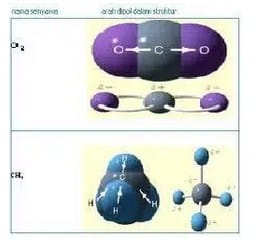 Ukuran Kuantitatif Titik Didih Senyawa Kovalen
Ukuran Kuantitatif Titik Didih Senyawa Kovalen
Dalam hal ini untuk senyawa polar titik didihnya lebih tinggi dari pada senyawa non polar seperti yaitu:
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Unsur Kimia dan Asal usulnya Terlengkap
- Urutan titik didih, ikatan hidrogen > dipol-dipol > non polar-non polar atau ikatan hidrogen > van der waals > gaya london.
- Bila sama-sama polar/non polar, yang Mr besar titik didihnya lebih besar.
Untuk senyawa karbon Mr sama, rantai C memanjang titik didih > rantai bercabang “bulat”.
Polarisasi Ikatan Kovalen
Suatu ikatan kovalen disebut polar, jika Pasangan Elektron Ikatan (PEI) tertarik lebih kuat ke salah 1 atom.
Contoh 1 : Molekul HCl
Meskipun atom H dan Cl sama-sama menarik pasangan elektron, tetapi keelektronegatifan Cl lebih besar daripada atom H.
Akibatnya atom Cl menarik pasangan elektron ikatan (PEI) lebih kuat daripada atom H sehingga letak PEI lebih dekat ke arah Cl (akibatnya terjadi semacam kutub dalam molekul HCl).
Jadi, kepolaran suatu ikatan kovalen disebabkan oleh adanya perbedaan keelektronegatifan antara atom-atom yang berikatan.
Sebaliknya, suatu ikatan kovalen dikatakan non polar (tidak berkutub), jika PEI tertarik sama kuat ke semua atom.
Contoh 2 :
Dalam tiap molekul di atas, ke-2 atom yang berikatan menarik PEI sama kuat karena atom-atom dari unsur sejenis mempunyai harga keelektronegatifan yang sama.
Akibatnya muatan dari elektron tersebar secara merata sehingga tidak terbentuk kutub.
Contoh 3 :
Meskipun atom-atom penyusun CH4 dan CO2 tidak sejenis, akan tetapi pasangan elektron tersebar secara simetris diantara atom-atom penyusun senyawa, sehingga PEI tertarik sama kuat ke semua atom (tidak terbentuk kutub).
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Atom Dan Teori Atom Menurut Para Ahli Terlengkap
Sifat – Sifat Senyawa Kovalen
Sifat-sifat senyawa kovalen antara lain kebanyakan menunjukkan titik leleh rendah, pada suhu kamar berbentuk cairan atau gas, larut dalam pelarut non polar dan sedikit larut dalam air, sedikit menghantarkan listrik, mudah terbakar dan banyak yang berbau.
Jadi dapat disimpulkan bahwa secara umum, senyawa polar larut dalam pelarut polar, sedangkan senyawa nonpolar larut dalam pelarut nonpolar. Air merupakan pelarut universal yang bersifat polar.
Oleh karena itu, air akan melarutkan senyawa-senyawa yang bersifat polar, dan sebaliknya, tidak melarutkan senyawa nonpolar. Berdasarkan sifat pelarut air tersebut, maka kita dapat mengetahui kepolaran suatu senyawa dengan menguji kelarutannya dalam air.
Perbedaan Senyawa Polar Dengan Non Polar
Ada beberapa perbedaan senyawa polar dengan non polar yang diantaranya yaitu:
Senyawa Polar
- Dapat larut dalam air.
- Memiliki pasangan eketron bebas “bentuk tidak simteris”.
- Berakhir ganjil, kecuali BX3 dan PX5.
Contoh: NH3, PCI3, H2O, HCI, HBr, SO3, N2O5, CI2O5.
Senyawa Non Polar
- Tidak dapat larut dalam air.
- Tidakn memiliki pasangan elektron bebas “bentuk simteris”.
- Berakhir genap.
Contoh: F2, CI2, Br2, I2, O2, H2, N2, CH4, SF6, PCI5, BCI3.
Senyawa polar memiliki perbedaan keelektronegatifan yang besar, perbedaan harga ini mendorong timbulnya kutub kutub listrik yang permanen ( dipol permanent ) Jadi antar molekul polar terjadi gaya tarik dipol permanent.
Senyawa non polar memiliki perbedaan keelektronegatifan yang kecil, bahkan untuk senyawa biner dwiatom ( seperti O2,H2) perbedaan keelektronegatifannya = 0 .
Bila terdapat senyawa non polar terjadi gaya tarik dipol sesaat ( gaya dispersi/ gaya london ) gaya ini terjadi akibat muatan + inti atom salah satu atom menginduksi elektron atom lain sehingga terjadilah kutub kutub yang sifatnya sesaat.
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Molekul Dalam Biologi Dan Contohnya Lengkap