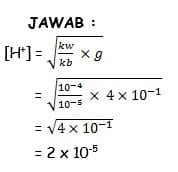Hidrolisis Garam : Pengertian, Macam, Dan Rumus, Beserta Contoh Soalnya Secara Lengkap – Tahukah anda apa yang dimaksud dengan Hidrolisis Garam ??? Jika anda belum mengetahui nya anda tepat sekali mengunjungi gurupendidikan.com.
Karena pada kesempatan kali ini disini akan mengulas tentang pengertian Hidrolisis Garam, macam Hidrolisis Garam, dan rumus Hidrolisis Garam beserta contoh soalnya secara lengkap. Oleh karena itu marilah simak ulasan yang ada dibawah berikut ini.
Baca Juga Artikel Yang Mungkin Berhubungan : Hukum Archimides : Pengertian, Bunyi, Rumus Dan Contoh Soalnya Lengkap
Pengertian Hidrolisis Garam
Hidrolisis garam adalah “terurainya garam dalam air yang menghasilkan asam dan basa.”
Bagaimanakah Hidrolisis dapat terjadi?
Hidrolisis garam hanya terjadi JIKA salah satu atau kedua komponen penyusun garam tersebut berupa asam lemah dan atau basa lemah. Jika komponen garam tersebut berupa asam kuat dan basa kuat, maka komponen ion dari asam kuat atau pun basa kuat tersebut Tidak akan terhidrolisis.
Baca Juga Artikel Yang Mungkin Berhubungan : Laju Reaksi : Pengertian, Faktor Yang Mempengaruhi, Dan Rumus Beserta Contoh Soalnya Lengkap
Berdasarkan penjelasan tadi, maka kation dan anion yang dapat mengalami reaksi hidrolisis adalah kation dan anion garam yang termasuk elektrolit lemah. Sedangkan kation dan anion garam yang termasuk elektrolit kuat tidak terhidrolisis.
Reaksi garam dengan air, dimana komponen garam (kation atau anion) yang berasal dari asam lemah atau basa lemah bereaksi dengan air membentuk ion H3O+(=H+) atau ion OH–.
Jika hidrolisis menghasilkan H3O+ maka larutan bersifat asam, tetapi jika hidrolisis menghasilkan ion OH– maka larutan bersifat basa.
Baca Juga Artikel Yang Mungkin Berhubungan : Larutan Elektrolit : Pengertian, Ciri, Dan Jenis Beserta Contohnya Secara Lengkap
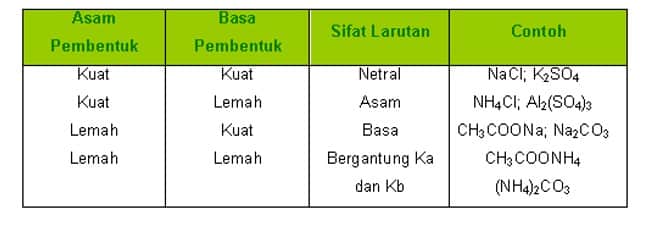
SIFAT ASAM-BASA LARUTAN
Pencampuran larutan asam dengan larutan basa akan menghasilkan garam dan air. Reaksi asam dengan basa membentuk garam di sebut reaksi penetralan. Namun demikian, garam dapat bersifat asam, basa maupun netral.
Sifat garam bergantung pada jenis komponen asam dan basanya. Garam dapat terbentuk dari asam kuat dengan basa kuat, asam lemah dengan basa kuat, asam kuat dengan basa lemah, atau asam lemah dengan basa lemah.
Jadi, sifat asam basa suatu garam dapat ditentukan dari kekuatan asam dan basa penyusunnya. Sifat keasaman atau kebasaan garam ini disebabkan oleh sebagian garam yang larut bereaksi dengan air. Proses larutnya sebagian garam bereaksi dengan air ini disebut hidrolisis (hidro yang berarti air dan lisis yang berarti peruraian).
Baca Juga Artikel Yang Mungkin Berhubungan : Larutan Buffer : Pengertian, Fungsi, Dan Jenis Beserta Contohnya Secara Lengkap
JENIS GARAM YANG DAPAT TERHIDROLISIS
Garam terdiri dari empat jenis, yang terbagi berdasarkan komponen asam basa pembentuknya.
Baca Juga Artikel Yang Mungkin Berhubungan : Larutan Garam : Pengertian, Ciri, Dan Sifat Beserta Contohnya Secara Lengkap
Macam-Macam Hidrolisis Garam
Jika ditinjau dari komponen pembentuk garam serta banyak tidaknya garam tersebut dapat diuraikan ketika direaksikan dengan air, maka reaksi hidrolisis dapat dibedakan sebagai berikut ini.
1. Hidrolisis parsial
Hidrolisis parsial ialah ketika garam direaksikan dengan air hanya salah satu/sebagian ion saja yang mengalami reaksi hidrolisis, sedangkan yang lainnya tidak. Komponen penyusun garam yang mengalami reaksi hidrolisi parsial ini ialah asam lemah dan basa kuat atau sebaliknya.
2. Hidrolisis total
Hidrolisis total merupakan reaksi penguraian seluruh garam oleh air, yang mana komponen garam terdiri dari asam lemah dan basa lemah.
Berdasarkan jenis ion-ion yang dihasilkan ketika garam terlarut dalam air, proses hidrolisis dapat dibedakan menjadi beberapa macam berikut ini.
Baca Juga Artikel Yang Mungkin Berhubungan : Larutan Basa : Pengertian, Ciri, Dan Sifat Beserta Contohnya Secara Lengkap
3. Hidrolisis Anion
Apabila garam yang terdiri dari komponen molekul asam lemah dan basa kuat direaksikan dengan molekul air, maka garam-garam ini hanya akan terhidrolisis sebagian/parsial didalam air dan akan menghasilkan ion yang bersifat basa (OH-). Dengan kata lain, yang terhidrolisis adalah sedangkan anion dari asam lemah sedangkan kation dari basa kuat tidak terhidrolisis.
Misal:
CH3COONa(aq) → CH3COO–(aq) + Na+ (aq)
CH3COO– + H2O ↔ CH3COOH + OH–
Na+ + H2O → tidak terjadi reaksi
Dari contoh diatas, menjelaskan bahwa CH3COO– yang bertindak sebagai anion asam lemah terhidrolisis membentuk OH– ketika direaksikan dengan molekul air (H2O) sedangakn Na+ yang bertindak sebagai kation dari basa kuat tidak terhidrolisis ketika direkasikan dengan molekul air.
Kesimpulannya garam dengan komponen pembentuk asam lemah dan basa kuat, jika direaksikan dengan air akan terhidrolisis sebagian dan menghasilkan ion yang bersifat basa.
Baca Juga Artikel Yang Mungkin Berhubungan : Larutan Asam : Pengertian, Ciri, Dan Sifat Beserta Contohnya Secara Lengkap
4. Hidrolisis Kation
Serupa halnya dengan reaksi hidrolisis antara garam dengan komponen molekul asam lemah dan basa kuat direaksikan dengan molekul air, jika garam dengan komponen penyusun asam kuat dan basa lemah dilarutkan ke dalam molekul air juga akan mengalami hidrolisis parsial dan menghasilkan ion yang bersifat asam (H+). Hal ini terjadi karena hanya kation dari basa lemah terhidrolisis, sedangkan anion dari asam kuat tidak mengalami hidrolisis.
Misal:
NH4Cl → NH4+ + Cl–
NH4+ + H2O ↔ NH4OH + H+
Cl– + H2O → tidak terjadi reaksi
Berdasarkan contoh diatas, dapat dijelaskan bahwa NH4+ yang bertindak sebagai basa lemah terhidrolisis menghasilkan ion yang bersifat asam, yakni H+. Sedangkan Cl- yang sebagai anion asam kuat tidak terhidrolisis.
Baca Juga Artikel Yang Mungkin Berhubungan : Getaran Harmonik : Pengertian, Syarat, Dan Rumus Beserta Contoh Soalnya Secara Lengkap
5. Kation dan Anion Terhidrolisis
Apabila garam dengan komponen asam lemah dan basa lemah direaksikan dengan molekul air akan mengalami hidrolisis total. Hal tersebut dapat terjadi dikarenakan kation dari basa lemah maupun anion dari asam lemah dapat terhidrolisis secara sempurna. Reaksi hidrolisis ini menghasilkan ion H+ atau OH-.
Misal:
CH3COONH4 → CH3COO– + NH4+
CH3COO– + H2O ↔ CH3COOH + OH–
NH4+ + H2O ↔ NH4OH + H+
Contoh diatas, menjelaskan bahwa kedua komponen penyusun garam CH3COO– (anion dari asam lemah) dan NH4+ (kation dari basa lemah) dapat terhidrolsis secara sempurna yang masing-masing berurutan menghasilkan ion yang bersifat basa (OH–) dan ion yang bersifat asam (H+).
Contoh Soal Hidrolisis Garam
1. Konsentrasi dari NH4Cl 0,4 M, jika kb NH3 = 10-5
Jawab:
hidrolisis1
2. pH dari NH4Cl 0,4 M adalah (kb NH3 = 10-5)
jawab:
Berikut ini adalah beberapa contoh beserta penyelesaian soal-soal yang berkaitan dengan hidrolisis garam yang baru saja kita pelajarai bersama :
- Berapakah pH larutan dari 100 mL larutan natrium sianida 0,01 M? (Ka HCN = 10-10)
Penyelesaian :
Larutan natrium sianida terbentuk dari campuran basa kuat (NaOH) dengan asam lemah (HCN). Dengan demikian, larutan garam tersebut mengalami hidrolisis parsial dan bersifat basa.
NaCN(aq) → Na+(aq) + CN–(aq)
Ion yang terhidrolisis adalah ion CN–. Konsentrasi ion CN– adalah 0,01 M. Dengan demikian, pH larutan garam dapat diperoleh melalui persamaan berikut :
[OH–] = {(Kw /Ka)([ion yang terhidrolisis])}1/2
[OH–] = {(10-14 / 10-10)(0,01)}1/2
[OH–] = 10-3 M
Dengan demikian, pOH larutan adalah 3. Jadi, pH larutan garam tersebut adalah 11.
- Berapakah pH larutan dari 200 mL larutan barium asetat 0,1 M? (Ka CH3COOH = 2.10-5)
Penyelesaian :
Larutan barium asetat terbentuk dari campuran basa kuat (Ba(OH)2) dengan asam lemah (CH3COOH). Dengan demikian, larutan garam tersebut mengalami hidrolisis parsial dan bersifat basa.
Ba(CH3COO)2(aq) → Ba+2(aq) + 2 CH3COO–(aq)
Ion yang terhidrolisis adalah ion CH3COO–. Konsentrasi ion CH3COO– adalah 0,2 M. Dengan demikian, pH larutan garam dapat diperoleh melalui persamaan berikut :
[OH–] = {(Kw /Ka)([ion yang terhidrolisis])}1/2
[OH–] = {(10-14 / 2.10-5)(0,2)}1/2
[OH–] = 10-5 M
Dengan demikian, pOH larutan adalah 5. Jadi, pH larutan garam tersebut adalah 9.
- Hitunglah pH larutan NH4Cl 0,42 M! (Kb NH4OH = 1,8.10-5)
Penyelesaian :
Larutan amonium klorida terbentuk dari campuran basa lemah (NH4OH) dengan asam kuat (HCl). Dengan demikian, larutan garam tersebut mengalami hidrolisis parsial dan bersifat asam.
NH4Cl(aq) → NH4+(aq) + Cl–(aq)
Ion yang terhidrolisis adalah ion NH4+. Konsentrasi ion NH4+ adalah 0,42 M. Dengan demikian, pH larutan garam dapat diperoleh melalui persamaan berikut :
[H+] = {(Kw /Kb)([ion yang terhidrolisis])}1/2
[H+] = {(10-14 / 1,8.10-5)(0,42)}1/2
[H+] = 1,53.10-5 M
Dengan demikian, pH larutan garam tersebut adalah 4,82.
- Hitunglah pH larutan NH4CN 2,00 M! (Ka HCN = 4,9.10-10 dan Kb NH4OH = 1,8.10-5)
Penyelesaian :
Larutan amonium sianida terbentuk dari campuran basa lemah (NH4OH) dengan asam lemah (HCN). Dengan demikian, larutan garam tersebut mengalami hidrolisis total.
NH4Cl(aq) → NH4+(aq) + CN–(aq)
Ion yang terhidrolisis adalah ion NH4+ dan ion CN–. Dengan demikian, pH larutan garam dapat diperoleh melalui persamaan berikut :
[H+] = {Kw (Ka/Kb)}1/2
[H+] = {10-14 (4,9.10-10 / 1,8.10-5)}1/2
[H+] = 5,22.10-10 M
Dengan demikian, pH larutan garam tersebut adalah 9,28.
- Berapakah massa garam NaCN yang harus dilarutkan untuk membentuk 250 mL larutan dengan pH sebesar 10? (Ka HCN = 10-10 dan Mr NaCN = 49)
Penyelesaian :
Larutan natrium sianida terbentuk dari campuran basa kuat (NaOH) dengan asam lemah (HCN). Dengan demikian, larutan garam tersebut mengalami hidrolisis parsial dan bersifat basa.
NaCN(aq) → Na+(aq) + CN–(aq)
pH = 10, berarti pOH = 4
Dengan demikian, [OH–] = 10-4 M
Perhitungan pH larutan garam dapat diperoleh melalui persamaan berikut :
[OH–] = {(Kw/Ka)([ion yang terhidrolisis])}1/2
10-4 = {(10-14 / 10-10)[ion yang terhidrolisis]}1/2
[ion yang terhidrolisis] = 10-4 M
Konsentrasi garam NaCN yang diperlukan sebesar 10-4 M. Volume larutan sebanyak 250 mL = 0,25 L. Dengan demikian, mol garam NaCN yang dibutuhkan adalah :
Mol = Volume x Molar
Mol = 0,25 x 10-4 = 2,5 x 10-5 mol
Jadi, massa garam NaCN yang dibutuhkan sebanyak 2,5 x 10-5 x 49 = 1,225 x 10-3 gram = 1,225 mg.
Itulah ulasan lengkapnya Semoga apa yang diulas diatas bermanfaat bagi pembaca. Sekian dan Terima Kasih.