Pengertian Laju Reaksi
Laju reaksi dapat didefinisikan sebagai perubahan konsentrasi pereaksi atau produk persatuan waktu. Artinya terjadi pengurangan konsentrasi pereaksi atau pertambahan konsentrasi produk tiap satuan waktu (Keenan,1990). Laju Reaksi atau kecepaan reaksi adalah laju atau kecepatan berkurangnya pereaksi atau terbentuknya produk reaksi yang dapat dinyatakan dalam satuan (konsentrasi per waktu) mol/L/s (untuk zat berwujud cair dan padat), atau atm/s (untuk zat berwujud gas). Kecepatan reaksi adalah banyaknya mol/liter suatu zat yang dapat berubah menjadi zat lain dalam setiap satuan waktu.Persamaan laju reaksinya adalah;
V = K[A][B]2
Dimana V adalah laju reaksi, K adalah konstanta laju reaksi dan [A][B] adalah konsentrasi dari zat yang bereaksi.nilai pangkat menyatakan koefisien zat ataupun orde dari reaksi tersebut. Orde reaksi berrti menjelaskan tentang tingkat reaksi atau hubungan antara konsentrasi dengan kecepatan (Petrucci,1985).
Persamaan laju reaksi mempunyai dua penerapan utama, yaitu penerapan praktis dan penerapan teoritis. Dikatakan untuk penerapan praktis adalah dimana telah diketahui persamaaan laju reaksi dan konstanta laju reaksi, dapat diramalkan laju reaksi dari komposisi campuran , sedangkan penerapan teoritis adalah dimana laju persamaan digunakan untuk menentukan mekanisme reaksi (Atkins,1990).
Laju reaksi terukur, sering kali sebanding dengan konsentrasi reaktan suatu pangkat. Contohnya, laju itu sebanding dengan konsentrasidua reaktan A dan B, sehingga;
V = K[A][B]2
Koefisien K disebut konstanta laju yang tidak bergantung pada konsentrasi tetapi bergantung pada temperatur. Persamaan sejenis ini yang ditentukam secara eksperimen disebut hukum laju reaksi. Secara formal, hukum laju adala persamaan yang menyatakan laju reaksi V sebagai fungsi dari konsentrasi semua spesies yang ada termasuk produknya (Atkins, 1990).
Tetapan Laju reaksi disebut juga koefisien laju atau laju reaksi jenis, dengan lambing k (konstanta). Tetapan laju adalah tetapan perbandingan antara laju reaksi dan hasi kali konsentrasi spesi yang mempengaruhi laju reaksi. Tetapan laju juga merupakan perubahan konsentrasi pereaktan atau produk reaksi per satuan waktu dalam suatu reaksi jika konsentrasi semua pereaksi sama dengan satu.
Laju keseluruhan dari suatu reaksi kimia pada umumnya bertambah jika konsentrasi suatu pereaksi atau lebih dinaikan. Hubungan antara laju dan konsentrasi dapat diperoleh dari data eksperimen. Laju reaksinya dapat berbanding lurus dengan [A]x dan [B]y. Hukum Laju reaksi yaitu persamaan yang mengaitkan laju reaksi dengan konsentrasi molar atau tekanan parsial pereaksi dengan pangkat yang sesuai. Laju = suatu tetapan dikalikan dengan suatu fungsi konsentrasi atau tekanan parsialpereaksi.untuk contoh reaksi di atas dapat dituliskan dalam bentuk hokum laju reaksi atau persamaan laju reaksi.
Laju reaksi adalah berkurangnya jumlah konsentrasi pereaksi untuk setiap satuan waktu atau bertambahnya jumlah konsentrasi hasil reaksi untuk setiap satuan waktu.Dinyatakan dengan satuan molaritas per detik ( M / detik atau mol / L.detik ).
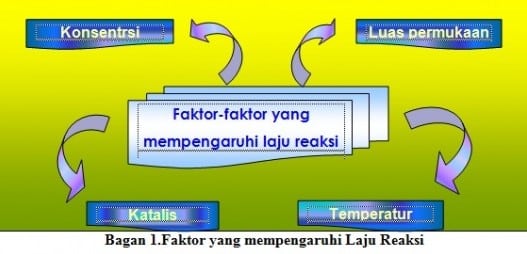
Faktor-faktor yang mempengaruhi laju reaksi
Ada 4 faktor yang mempengaruhi laju reaksi, yaitu:
-
Konsentrasi
Konsentrasi mempengaruhi laju reaksi, karena banyaknya partikel memungkinkan lebih banyak tumbukan, dan itu membuka peluang semakin banyak tumbukan efektif yang menghasilkan perubahan. (Purwanti Widhy Hastuti).

Pengaruh konsentrasi juga berkaitan dengan jumlah partikel yang terlibat dalam tumbukan. Apabila konsentrasi pereaksi bertambah, maka jumlah partikel-partikel akan meningkat. Dengan demikian, partikel tersebut malah menjadi lebih dekat dan jumlah tumbukan efektif juga akan meningkat, sehingga akan meningkatkan laju reaksi.
-
Suhu
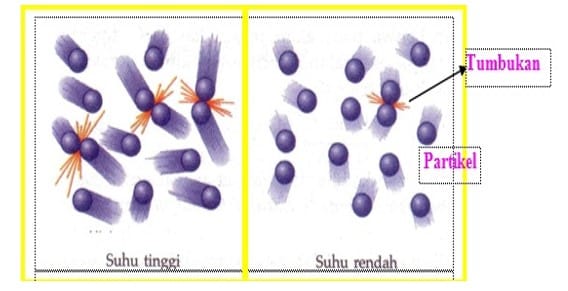
suhu laju suatu reaksi kimia bertambah dengan naiknya temperatur. dengan naiknya temperatur, bukan hanya molekul molekul lebih sering bertabrakan , tetapi mereka juga bertabrakan dengan dampak (benturan) yang lebih besar , karena merka bergerak lebih cepat.pada temperatur yang tinggikan, persentasi tabrakan yang mengakibatkan reaksi kimia akan lebih besar, karena makin banyak molkekul yang memiliki kecepatan lebih besar dan karenanya memiliki energi cukup untuk beraksi. ( keenan, 1984).
Pengaruh suhu terhadap laju reaksi terkait dengan nilai energi kinetik partikel. Apabila suhu dinaikkan, maka energi kinetik partikel akan bertambah. Dengan demikian, lebih banyak partikel yang akan memiliki energi kinetik minimum ≥ Ea. Hal ini menyebabkan jumlah tumbukan efektif bertambah, sehingga laju reaksi meningkat. Hal ini ditunjukkan paad gambar berikut:
-
Luas Permukaan Sentuh
Pada zat padat yang bereaksi adalah atom- atom atau molekul- molekul yang terdapat pada permukaannya, sedangkan atom atau molekul yang terdapat pada bagian sebelah dalam tertutup dari luar, sehingga tidak bisa bereaksi. Banyaknya ‘muka’ yang berada dibagian sebelah luar disebut sebagai luas permukaan. Makin luas permukaan zat pereaksi, maka peluang untuk bereaksi akan makin besar sehingga laju reaksinya juga akan makin cepat. (Endang Widjajanti).
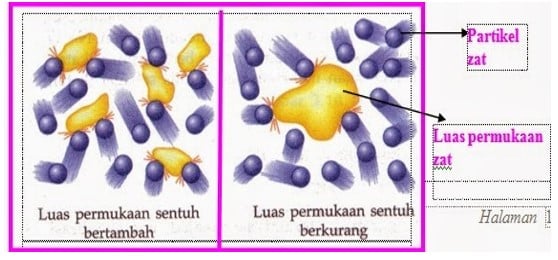
Pengaruh luas permukaan sentuh terkait dengan mudah tidaknya partikel-partikel pereaksi untuk bertemu. Apabila luas permukaan sentuh bertambah, maka partikel-partikel lebih mudah bertemu sehingga jumlah tumbukan efektif akan meningkat, sehingga laju reaksi juga meningkat.
-
Katalis
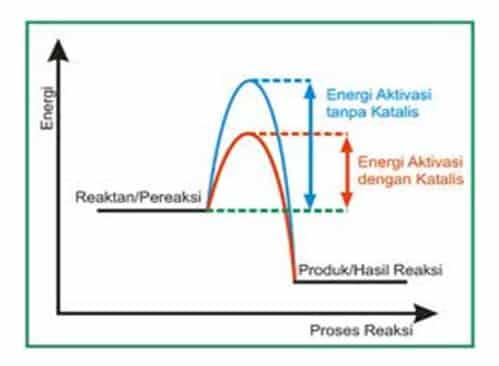
katalis adalah zat yang ditambahka kedalam suatu reaksi dengan maksud memperbesar kecepatan reaksi. katalis kadang ikut terlibat dalam reaksi tetapi tidak mengalami perubahan kimia yang permanen. karena itu kehadirannya biasa ditandai dengan notasi diatas tanda panah reaksi. dengan kata lain pada akhir reaksi, katalis akan dijumpai kembali dlam bentuk da jumlah yang sama seperti sebelum reaksi. berhasl atau gagalnya suatu proses komersial untuk menghasilkan suatu senyawa sering tergantung pada penggunaan katalis yang cocok. peningkatan suhu adalah salah satu cara untuk meningkatkan fraksi molekul yang memiliki energi melebihi energi aktivasi. cara lain yang tidak memerlukan peningkatan suhu adalah mendapatkan jalan reaksi dengan energi aktivasi yag lebih rendah. (petrucci, 1987)
Peran katalis di dalam mempengaruhi laju reaksi terkait dengan energi pengaktifan reaksi, Ea. Katalis yang digunakan untuk mempercepat reaksi memberikan suatu mekanisme reaksi alternatif dengan nilai Ea yang lebih rendah dibandingkan Ea reaksi tanpa katalis. Dengan Ea yang lebih rendah, maka lebih banyak partikel yang memiliki energi kinetik yang cukup untuk mengatasi halangan Ea yang rendah ini. hal ini menyebabkan jumlah tumbukan efektif akan bertambah, sehingga laju reaksi juga akan meningkat.
Jenis-jenis katalis yaitu :
- Katalis Homogen
Adalah katalis yang wujudnya sama dengan wujud reaktannya.
Dalam reaksi kimia, katalis homogen berfungsi sebagai zat perantara ( fasilitator ).
Contohnya :
- Katalis gas NO2 pada pembuatan gas SO3.
- Katalis gas Cl2 pada penguraian N2O
- Katalis Heterogen
Adalah katalis yang wujudnya berbeda dengan wujud reaktannya.
Reaksi zat-zat yang melibatkan katalis jenis ini, berlangsung pada permukaan katalis tersebut.
Contohnya :
- Katalis logam Ni pada reaksi hidrogenasi etena ( C2H4 ).
- Katalis logam Rodium atau Iridium pada proses pembuatan asam etanoat.
- Katalis logam Ni pada proses pembuatan mentega.
- Katalis logam V2O5 pada reaksi pembuatan asam sulfat ( proses Kontak ).
- Katalis logam Fe pada reaksi pembuatan amonia ( proses Haber-Bosch )
- Biokatalis ( enzim ).
- Adalah katalis yang dapat mempercepat reaksi-reaksi kimia dalam tubuh makhluk hidup.
- Mekanisme kerjanya dengan metode “ kunci dan gembok “ atau “ lock and key “ yang dipopulerkan oleh Emil Fischer.
- Contohnya :
- Biokatalis ( enzim ).
- Enzim amilase = membantu menghidrolisis amilum menjadi maltosa.
- Enzim katalase = menguraikan H2O2 menjadi O2 dan H2O
- Enzim lipase = menguraikan lipid menjadi gliserol dan asam lemak.
- AutoKatalis
Adalah zat hasil reaksi yang berfungsi sebagai katalis. Artinya, produk reaksi yang terbentuk akan mempercepat reaksi kimia.
Contohnya :
Reaksi antara kalium permanganat ( KMnO4 ) dengan asam oksalat ( H2C2O4 ) salah satu hasil reaksinya berupa senyawa mangan sulfat ( MnSO4 ).
Semakin lama, laju reaksinya akan semakin cepat karena MnSO4 yang terbentuk berfungsi sebagai katalis.
Teori Tumbukan
Suatu zat dapat bereaksi dengan zat lain jika partikel-partikelnya saling bertumbukan. Tumbukan yang terjadi akan menghasilkan energi untuk memulai terjadinya reaksi. Terjadinya tumbukan tersebut disebabkan karena partikel-partikel zat selalu bergerak dengan arah yang tidak teratur. Tumbukan antar partikel yang bereaksi tidak selalu menghasilkan reaksi. Hanya tumbukan yang menghasilkan energi yang cukup serta arah tumbukan yang tepat, yang dapat menghasilkan reaksi. Tumbukan seperti ini disebut tumbukan yang efektif.
Jadi, laju reaksi tergantung pada 3 hal :
- Frekuensi tumbukan
- Energi partikel reaktan
- Arah tumbukan
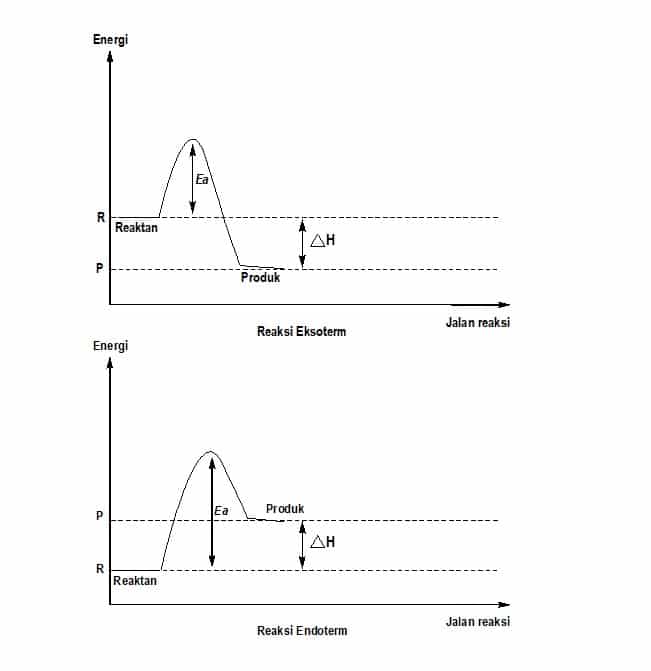
- Energi minimum yang harus dimiliki oleh partikel reaktan, sehingga menghasilkan tumbukan yang efektif disebut energi pengaktifan atau energi aktivasi ( Ea ).
- Semua reaksi, baik eksoterm maupun endoterm memerlukan Ea. Reaksi yang dapat berlangsung pada suhu rendah berarti memiliki Ea yang rendah. Sebaliknya, reaksi yang dapat berlangsung pada suhu yang tinggi, berarti memiliki Ea yang tinggi.
- Ea ditafsirkan sebagai energi penghalang ( barrier ) antara reaktan dengan produk. Reaktan harus didorong agar dapat melewati energi penghalang tersebut sehingga dapat berubah menjadi produk.
Contoh Soal Laju Reaksi
- Suatu reaksi berlangsung pada suhu 20 0C. Bila pada setiap kenaikan 10 0C tetapan laju reaksinya meningkat 2 kali, maka laju reaksi pada 60 0C dibandingkan dengan 20 0C akan meningkat sebanyak berapakali?
Jawab:
Setiap kenaikan 10 0C maka laju = 2 kali semula, maka:
V20 = V1 . 2
V60 = V20 . 240/10
= 16 x V20
- Bila suhu suatu reaksi dinaikkan 10 0C maka laju reaksinya akan menjadi 2x lipat, jika pada suhu t 0C reaksi berlangsung selama 12 menit, maka pada suhu (t + 30)0C, reaksi akan berlamngsung selama…..
Jawab:
Setiap kenaikan suhu 10 0C maka laju reaksi = 2x lipat (waktu menjadi ½ kali semula):
t2 = t1 x (1/2)
t(t+30) = 12 menit x (1/2)30/10
= 1,5 menit
- Nitrogen oksida, NO, bereaksi dengan hydrogen membentuk dinitrogen oksida dan uap air:
2 NO(g) + H2(g) à N2O(g) + H2O(g)
Pengaruh konsentrasi NO dan H2 terhadap laju reaksi terdapat pada table berikut:
| Percobaan | Konsentrasi Awal | Laju Reaksi Awal (mdet-1) | |
| NO | H2 | ||
| 1 | 6,4×10-3 | 2,2×10-3 | 2,6×10-5 |
| 2 | 12,8×10-3 | 2,2×10-3 | 1,0×10-4 |
| 3 | 6,4×10-3 | 4,4×10-3 | 5,1×10-5 |
Tentukanlah:
- orde reaksi terhadap NO
- orde reaksi terhadap H2
- persamaan laju reaksi
- harga orde reaksinya
- harga dan satuan tetapan laju reaksi (k)
- laju reaksi jika konsentrasi NO dan H2 masing-masing 0,5 M
Jawab:
Misal persamaan laju reaksinya, V= k [NO]x [H2]y
- orde reaksi terhadap NO ditentukan dari percobaan 1 dan 2 :
Jadi, orde reaksi terhadap NO = 2
- orde reaksi terhadap H2 ditentukan dari percobaan 1 dan 3:
Jadi, orde reaksi terhadap H2 = 1
- Persamaan laju reaksi = V = k.[NO]2[H2]
- Orde reaksi keseluruhan : 2 + 1 = 3
- Dari persamaan laju reaksi
V = k.[NO]2[H2]
Berdasar pers. 1 diperoleh:
k ==…..
- Persamaan laju reaksi lengkap
V = k [NO]2.[H2]
Jika [NO] = 0,5 M dan [H2] = 0,5 M
Maka nilai V adalah:
V = k (0,5)2.(0,5)
= …..
Mau yang Lebih Lengkap Lihat Pada Materi Laju Reaksi
DAFTAR PUSTAKA
Chang, Raymond. 2004. Kimia Dasar Konsep-Konsep Inti Edisi Ketiga Jilid2. Jakarta : Erlangga.
Petrucci, Ralph N. 1987. Kimia Dasar Prinsip dan Terapan Modern Jilid 2. Jakarta : Erlangga
Tyler, Miller G. 1931. Chemistry A Basic Introduction Third Edition.
California Wodsworth Publishing Company.