Ikatan Logam : Pengertian, Ciri, Sifat, Dan Proses Pembentukan Beserta Contohnya Lengkap
Tahukah anda apa yang dimaksud dengan ikatan logam ??? Jika anda belum mengetahuinya anda tepat sekali mengunjungi gurupendidikan.com. Karena pada kesempatan kali ini akan membahas tentang pengertian ikatan logam, ciri-ciri ikatan logam, sifat ikatan logam, proses pembentukan ikatan logam, dan contohnya secara lengkap. Oleh karena itu marilah simak ulasan yang ada dibawah berikut ini.
Pengertian Ikatan Logam
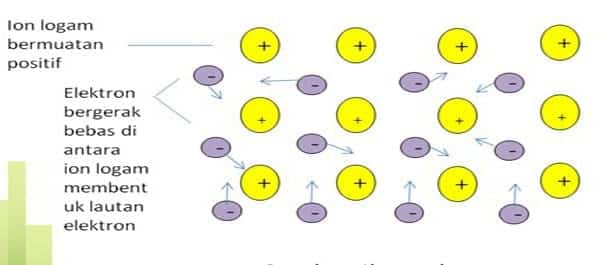
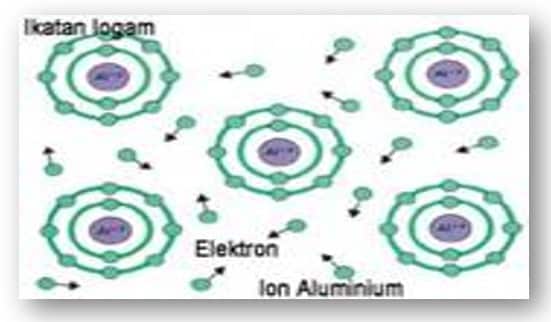
Ikatan logam adalah ikatan kimia yang terbentuk akibat penggunaan bersama electron elektron valensi antara tomatom logam. Contoh: logam besi, seng, dan perak. Ikatan logam bukanlah ikatan ion atau ikatan kovalen. Salah satu teori yang dikemukakan untuk menjelaskan ikatan logam adalah teori lautan elektron. Contoh terjadinya ikatan logam. Tempat kedudukan elektron valensi dari suatu atom besi (Fe) dapat saling tumpang tindih dengan tempat kedudukan elektron valensi dari atom-atom Fe yang lain.
Tumpang tindih antarelektron valensi ini memungkinkan elektron valensi dari setiap atom Fe bergerak bebas dalam ruang di antara ion-ion Fe+ membentuk lautan elektron. Karena muatannya berlawanan (Fe2+ dan 2 e–), maka terjadi gaya tarik-menarik antara ion-ion Fe+ dan elektron-elektron bebas ini. Akibatnya terbentuk ikatan yang disebut ikatan logam.
Ciri Ikatan Logam
- Atom-atom logam bisa diibaratkan seperti bola pingpong yang terjejal rapat satu sama lain.
- Atom logam memiliki sedikit elektron valensi, sehingga sangat mudah untuk dilepaskan dan membentuk ion positif.
- Maka dari itu kulit terluar atom logam relatif longgar (terdapat banyak tempat kosong) sehingga elektron bisa berpindah dari 1 atom ke atom lain.
- Mobilitas elektron dalam logam sedemikian bebas, sehingga elektron valensi logam mengalami suatu delokalisasi yaitu suatu keadaan dimana elektron valensi tersebut tidak tetap posisinya pada 1 atom, tetapi senantiasa berpindah-pindah dari 1 atom ke atom lain.
- Elektron-elektron valensi tersebut berbaur membentuk awan elektron yang menyelimuti ion-ion positif logam.
Adanya ikatan logam menyebabkan logam bersifat:
Logam bersifat padat pada temperatur dan tekanan standar, dengan pengecualian unsur merkuri dan galium yang keduanya berupa cairan. Sebagai pengingat, sifat-sifat logam yaitu sebagai berikut:
- Memiliki konduktivitas termal dan listrik yang tinggi.
- Berkilau dan memantulkan cahaya.
- Dapat ditempa.
- Memiliki variasi kekuatan mekanik.
Perlu diingat kembali bahwa ikatan logam adalah suatu kekuatan utama yang menyatukan atom-atom logam. Ikatan logam adalah akibat dari adanya tarik menarik muatan positif dari logam dan muatan negatif dari elektron yang bergerak bebas.
Sifat-sifat logam tidak bisa dimasukkan dalam kriteria ikatan seperti ikatan kovalen maupun ikatan ion. Senyawa ionik tidak bisa mengantarkan listrik pada fase padatan, dan senyawa ionik sifatnya rapuh (berlawanan dengan sifat logam). dan; Atom dari senyawa logam hanya mengandung satu sampai tiga elektron valensi. Dengan demikian atom tersebut tidak dapat membentuk ikatan kovalen. Senyawa kovalen adalah penghantar listrik yang buruk dan umumnya berupa cairan (dengan sifat berkebalikan dengan pembentukan logam). Dengan demikian, logam membentuk model ikatan yang berbeda.
Proses Pembentukan Ikatan Logam
Pada ikatan logam terjadi proses saling meminjamkan elektron, hanya saja jumlah atom yang bersama-sama saling meminjamkan elektron valensinya (elektron yang berada pada kulit terluar) ini tidak hanya antara dua melainkan beberapa atom tetapi dalam jumlah yang tidak terbatas. Setiap atom menyerahkan elektron valensi untuk dipakai bersama, dengan demikian akan ada ikatan tarik menarik antara atom-atom yang saling berdekatan.
Jarak antar atom ini akan tetap sama, maksudnya bila ada atom yang bergerak menjauh maka gaya tarik menarik akan menariknya kembali ke posisi semula dan jika bergerak terlalu mendekat maka akan timbul gaya tolak menolak karena inti-inti atom berjarak terlalu dekat padahal muatan listriknya sama sehingga kedudukan atom relatif terhadap atom lain akan tetap.
Pada ikatan logam, inti-inti atom berjarak tertentu dan terletak beraturan sedangkan elektron yang saling dipinjamkan seolah-olah membentuk kabut elektron. Dalam logam, orbital atom terluar yang terisi elektron menyatu menjadi suatu sistem terdelokalisasi yang merupakan dasar pembentukan ikatan logam. Delokalisasi adalah suatu keadaan dimana elektron valensi tidak tetap posisinya pada 1 atom, tetapi senantiasa berpindah-pindah dari satu atom ke atom lain.
Atom logam bisa berikatan sambung menyambung ke segala arah sehingga menjadi molekul yang besar sekali. Satu atom akan berikatan dengan beberapa atom lain disekitarnya. Akibatnya atom tersebut terikat kuat dan menjadi logam berwujud padat (kecuali Hg) dan umumnya keras.
Contoh ikatan logam :
Perbandingan Sifat Fisis Senyawa Logam dengan Senyawa Non Logam
| Logam | Non Logam | ||
| 1. | Padatan logam termasuk penghantar listrik yang baik | 1. | Padatan non logam biasanya bukan penghantar listrik |
| 2. | Mempunyai kilap logam | 2. | Tidak mengkilap |
| 3. | Kuat dan keras (apabila digunakan sebagai logam paduan) | 3. | Kebanyakan non logam tidak kuat dan lunak |
| 4. | Dapat dibengkokkan dan diulur | 4. | Biasanya rapuh dan patah bila dibengkokkan atau diulur |
| 5. | Penghantar panas yang baik | 5. | Sukar menghantarkan panas |
| 6. | Kebanyakan logam memiliki kerapatan yang besar | 6. | Kebanyakan non logam memiliki kerapatan rendah |
| 7. | Kebanyakan logam memiliki titik didih dan titik leleh yang tinggi | 7. | Kebanyakan non logam memiliki titik didih dan titik leleh yang rendah |
REAKSI SENYAWA LOGAM :
Logam-logam alkali mempunyai beberapa sifat fisik antara lain semuanya lunak, putih mengkilat, dan mudah dipotong. Jika logam-logam tersebut dibiarkan di udara terbuka maka permukaannya akan menjadi kusam karena logam-logam tersebut mudah bereaksi dengan air atau oksigen, dan biasanya disimpan dalam minyak tanah.
Bersamaan dengan semakin bertambahnya nomor atom maka tingkat kelunakannya juga semakin bertambah. Tingkat kelunakan logam-logam alkali makin bertambah sesuai dengan bertambahnya nomor atom logam-logam tersebut. Sifat-sifat kimia logam alkali tanah dapat diamati antara lain dari reaksinya terhadap air. Reaksinya dengan air menghasilkan gas hidrogen dan hidroksida serta cukup panas. Reaktivitas terhadap air dingin semakin bertambah besar dengan bertambahnya nomor logam.
Logam-logam alkali tanah, kecuali berilium semuanya berwarna putih, mudah dipotong dan nampak semakin mengkilat jika dipotong, serta cepat menjadi kusam di udara. Reaktivitasnya terhadap air berbeda-beda. Berilium dapat bereaksi dengan air dalam keadaan pijar dan airnya dalam bentuk uap. Magnesium bereaksi dengan air dingin secara lambat dan semakin cepat bila makin panas, logam-logam alkali tanah yang lain sangat cepat bereaksi dengan air dingin menghasilkan gas hidrogen dan hidroksida serta menghasilkan banyak panas.
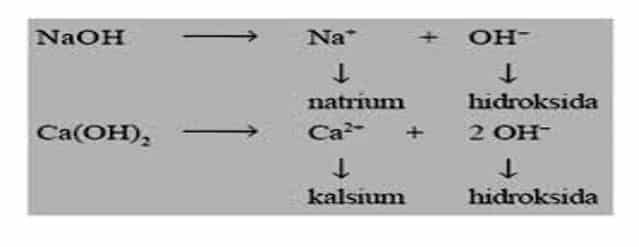
Senyawa klorida dari logam-logam alkali maupun alkali tanah larut dalam air membentuk ion hidrat sederhana. banyak klorida kovalen atau agak kovalen mengalami hidrolisis dan menghasilkan klorida dan oksida atau hidroksinya. Misalnya larutan aluminium klorida bereaksi dengan air membentuk aluminium hidroksida.
Itulah ulasan tentang Ikatan Logam : Pengertian, Ciri, Sifat, Dan Proses Pembentukan Beserta Contohnya Lengkap Semoga apa yang diulas diatas bermanfaat bagi pembaca. Sekian dan terimakasih.
Baca juga refrensi artikel terkait lainnya disini :
- Ikatan Kovalen : Pengertian, Jenis, Dan Proses Pembentukan Beserta Contoh Secara Lengkap.
- Termokimia : Pengertian, Sistem, Reaksi, Dan Rumus Beserta Contohnya Secara Lengkap
- √ Makalah Ikatan Kimia : Pengertian, Jenis Beserta Gambarnya Lengkap
- Ikatan Ion : Pengertian, Ciri, Dan Syarat Terjadinya, Serta Contohnya Lengkap