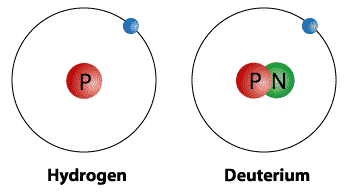
Sifat Deuterium – Pengertian, Lambang, Keberadaan, Menggantikan, Nuklir : Deuterium merupakan salah satu daripada tiga bentuk isotop hidrogen yang terdiri daripada protium, deuterium, dan tritium dimana disebut juga Hidrogen-2, atau hidrogen berat (simbol ditulis D atau 2H).
Pengertian Deuterium
Deuterium merupakan salah satu daripada tiga bentuk isotop hidrogen yang terdiri daripada protium, deuterium, dan tritium dimana disebut juga Hidrogen-2, atau hidrogen berat (simbol ditulis D atau 2H).
Baca Juga Artikel Yang Mungkin Berhubungan : Penjelasan Perbedaan Metanol Dan Bensin Lengkap
Dalam hal ini Deuterium terjadi dalam jumlah kecil yang secara alami sebagai gas Deuterium, yang ditulis 2H2 atau D2, tetapi kebanyakan terjadi secar di alam semesta terikat dengan atom 1H, gas yang disebut dengan hydrogen Deuterida “HD atau 1H2H”.
Dengan kelimpahan Deuterium tampaknya menjadi fraksi yang sangat mirip dengan hydrogen, yang dimana pun hydrogen ditemukan, dengan kehadiran Deuterium dengan fraksi rendah tapi konstan di semua hydrogen, diperkirakan bahwa kelimpahan Deuterium belum berkembang secara signifikan karena produksi mereka sekitar 13,7 miliar tahun lalu.
Kelimpahan Deuterium pada Jupiter ialah sekitar 2.25 x 10-5 “kira-kira 22 atom dalam satu juta atau 15% dari rasio Deuterium dengan hydrogen terrestrial”, Deuterium yang terkonsentrasi banyak digunakan untuk keperluan industry, ilmiah dan militer sebagai air berat dari air biasa. Pemasok terkemuka dunia dari Deuterium ialah Atomic Energy of Canada Limted di Kanada hingga pada tahun 1997 ketika pabrik ini terakhir di tutup.
Lambang Kimia Deuterium
Sebagai sebuah isotop hidrogen, lambang kimia yang disetujui untuk deuterium adalah 2H. Meskipun demikian, lambang tidak resmi, D, sering juga digunakan. Perbedaan signifikan pada berat atom relatif dibandingkan dengan protium murni (1H) mungkin adalah alasan mengapa lambang D, yang mirip lambang sebuah unsur, digunakan.
Berat atom dari deuterium adalah 2,014 amu, sementara berat rata-rata hidrogen sebesar 1,007947 amu, dan protium 1,007825 amu. Pada unsur-unsur kimia yang lain, rasio berat isotop sangat tidak signifikan, yang menjelaskan mengapa tidak ada simbol isotop yang unik digunakan di tempat lain.
Baca Juga Artikel Yang Mungkin Berhubungan : 6 Perbedaan Senyawa Polar Dengan Non Polar
Keberadaan Deuterium
Secara alami, deuterium ditemukan dalam jumlah kecil sebagai gas deuterium, ditulis 2H2 atau D2, tetapi kebanyakan keberadaanya secara alami di alam semesta terikat dengan atom 1H membentuk gas yang disebut hidrogen deuterida (HD atau 1H2H).
Deuterium Menggantikan Hidrogen
Deuterium dapat menggantikan hidrogen normal dalam molekul air untuk membentuk air berat, yang 10,6% lebih padat daripada air biasa (es yang terbuat darinya akan tenggelam di air biasa). Air berat cukup beracun bagi organisme eukariota, dimana penggantian 25% air di dalam tubuh dengan air berat dapat menyebabkan masalah pembelahan sel dan kemandulan, 50% penggantian menyebabkan kematian yang disebabkan oleh sindrom sitotoksik (kegagalan sumsum tulang dan pelapisan gastrointestinal).
Organisme prokariota masih mampu untuk bertahan dalam air berat murni (meskipun dengan pertumbuhan yang lambat). Konsumsi air berat bukan merupakan ancaman bagi manusia kecuali dalam jumlah yang sangat besar (melebihi 10 liter).
Dosis kecil air berat (beberapa gram adalah jumlah yang sebanding dengan yang ada di dalam tubuh) secara rutin digunakan sebagai pelacak metabolis yang tak berbahaya bagi manusia dan binatang.
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Larutan Dan Kelarutan Dalam Kimia Beserta Contohnya
Sifat Deuterium
- Simbol kimia Deuterium sering digambarkan sebagai D.
- Karena merupakan isotop hydrogen dengan nomor atom 2 juga diwakili oleh 2.
- Deuterium lebih tebal dari air biasa.
- Yang secara kimia, Deuterium berperilaku mirip dengan hydrogen biasa, akan tetapi ada perbedaan energy ikatan dan panjang untuk senyawa isotop hydrogen berat yang lebih besar dari perbedaan isotop dalam unsur lainnya.
- Deuterium dapat menggantikan hydrogen normal dalam molekul air untuk membentuk air berat “D2O”3. Yakni sekitar 10.6% lebih padat dari pada air biasa “cukup menjadikan es yang terbuat dari itu tenggelam dalam air biasa”.
- Ikatan yang melibatkan Deuterium dan tritium agak kuat dari pada ikatan yang sesuai dalam hydrogen ringan dan perbedaan ini cukup untuk membuat perubahan signifikan dalam reaksi biologis.
Sifat Nuklir Deuteron
- Inti Deuterium disebut “Deuteron”.
- Ini memiliki massa 2,013553212724 “78”.
- Radius muatan Deuterium ialah 2,1402 “28” meter, jari-jari muatan ialah ukuran dari ukuran inti atom, khususnyaa dari proton atau deuteron.
- Proton dan neutron yang membentuk deuterium dapat dipisahkan “proses umum dimana senyawa ionic (kompleks atau garam) yang terpisah atau terpecah menjadi partikel yang lebih kecil ion, biasanya dengan cara reversible” yang melalui interkasi arus netral dengan neutrino. Penampang untuk interaksi ini relatif besar dan deuterium telah berhasil digunakan sebagai neutrino sebagai target dalam sebuah percobaan Sudbury Neutrino Observatory di Kanada. Interaksi arus netral ialah salah satu cara dimana partikel subatomic dapat berinterkasi dengan cara gaya lemah, salah satu dari empat gaya fundamental alam, di samping gaya nuklir, elektromagnetik dan gravitasi.
- Karena kesamaan sifat massa dan inti antara proton dan neutron mereka kadang-kadang dianggap sebagai dua jenis benda yang simetris sebuah nucleon, yang sementara hanya proton yang memiliki muatan listrik, hal ini sering diabaikan karena lemahnya interaksi elektromagnetik relatif terhadap interaksi nuklir kuat “gaya antara dua atau lebih nucleon”, simetri yang berkaitan dengan proton dan neutron yang dikenal sebagai isospin dan dilambangkan I atau kadang-kadang T.
- Resonansi magnetik nuklir “NMR” frekuensi Deuterium berbeda secara signifikan dari hydrogen ringan biasa. Resonansi magnetic “NMR” ialah efek dimana inti magnetic dalam medan magnet menyerap dan memancarkan kembali energy elektromagnetik “EM”.
- Spektroskopi inframerah juga dengan mudah membedakan banyak senyawa yang mengandung Deuterium, karena perbedaan besar dalam frekuensi penyerapan infra merah terlihat dalam vibrasi ikatan kimia yang mengandung Deuterium dibandingkan cahaya hydrogen.
Baca Juga Artikel Yang Mungkin Berhubungan : Penjelasan Air Sebagai Pelarut Bagi Kehidupan